血液内科
診療内容
若年者を中心として、香川県内の専門的治療を要する血液疾患に対する治療を積極的に行っています。難治性造血器腫瘍を対象とした大量化学療法や造血幹細胞移植療法など、治癒を目指した集中的・集学的治療を、適応を加味した上で積極的に行っています。良性でも難治性の血液疾患で高度医療が必要な方を対象として治療しています。
当施設は骨髄バンク移植認定、骨髄バンク採取認定、臍帯血バンク移植認定となっており、血縁ドナーからの血縁者間同種幹細胞移植(末梢血幹細胞移植および骨髄移植)はもちろんのこと、骨髄バンクを介した非血縁者間同種移植(末梢血幹細胞移植および骨髄移植)、臍帯血移植、およびHLA半合致ドナー(ハプロ合致移植)といったすべての造血幹細胞移植療法に対応しています。また、香川県内での血液内科医常勤施設との連携を密に図っており、病院間相互での患者の紹介を必要に応じて行います。
新病棟では移植医療のためのクリーン・フロアを備え、チームを結成して診療に当たります。
対象症候
(1) リンパの異常
症候性リンパ節腫大、症候性リンパ節症、脾腫。
(2) 血球の異常
白血球増多、白血球減少。
原因不明の貧血、原因不明の血小板減少、原因不明の出血傾向。
(3) 出血傾向
歯肉出血、四肢の紫斑。
対応疾患
(1) 造血器腫瘍
白血病(急性骨髄性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病)、悪性リンパ腫、多発性骨髄腫など悪性造血器腫瘍の他、骨髄増殖性腫瘍に含まれる真性多血症、本態性血小板増多症、骨髄線維症などの良性造血器腫瘍。
(2) 造血不全
骨髄異形成症候群、各種栄養障害性の貧血、再生不良性貧血、発作性夜間血色素尿症、ファンコニ貧血、サラセミアなど。
(3) 出血性疾患・血液凝固線溶異常
特発性血小板減少性紫斑病、急性および慢性の汎発性血管内凝固症候群、血栓性血小板減少性紫斑病、血友病など。
データ
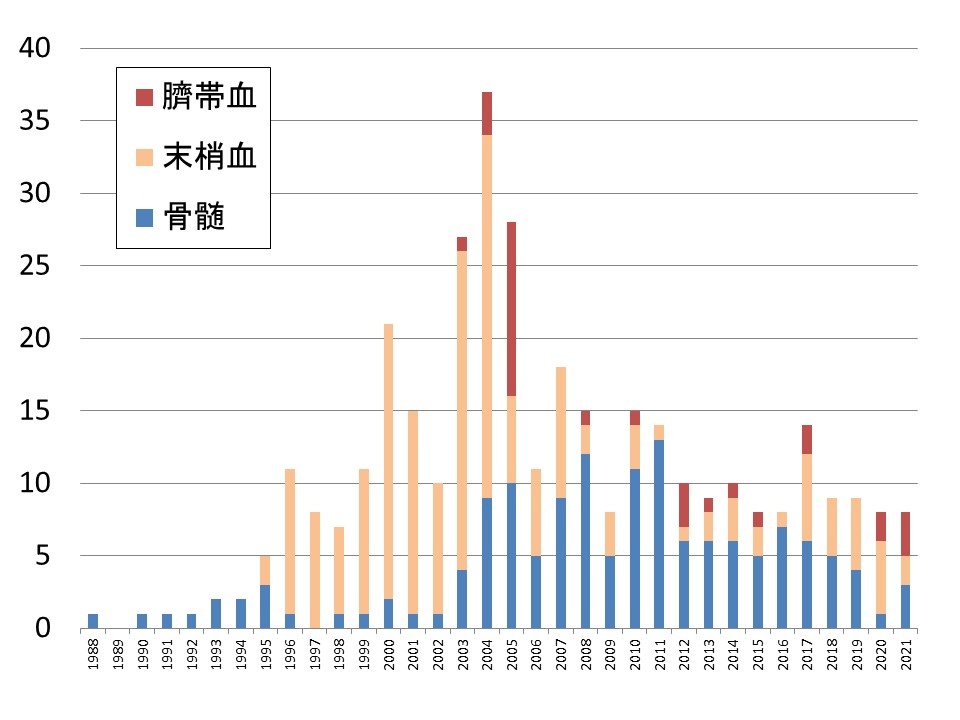
香川県内の血液内科常勤施設(「三豊総合病院」は非常勤が3名)
四国初! 難治性の白血病とリンパ腫を対象としたCAR-T細胞療法(キムリア®)の提供可能施設として認定
2022年2月21日、当院は、再発または難治性の白血病とリンパ腫に対する新たながん免疫療法である「CAR-T細胞療法」(キムリア※1)の提供可能施設として、四国の病院で初めて認定されました。これまで四国在住の「CAR-T細胞療法」の対象となる患者さんは本州の病院に紹介していましたが、今後海を渡ることなく当院でも治療を受けられることになります。
◆CAR-T細胞療法とは
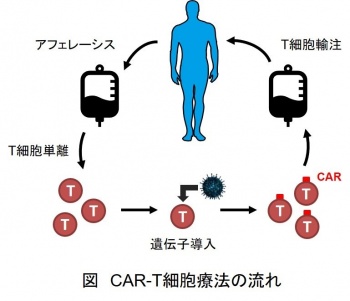
CAR–T細胞療法とは、患者さんの血液から白血球のひとつで免疫反応を担うT細胞を採取し、血液がん細胞を攻撃できるように「キメラ抗原受容体(CAR)」と呼ばれる特殊なタンパク質を遺伝子導入して患者さんのT細胞からCAR-T細胞を作製し、それを患者さんに投与することで、患者さん自身の免疫の働きを利用して、難治性のがん細胞を攻撃する革新的な治療法です(図)。この治療法により、従来の抗がん剤治療で治らなかった患者さんでも高い抗腫瘍効果が得られ、寛解を達成することが可能になりました。
◆ 対象となる患者さん
・再発・難治性のCD19陽性B細胞性急性リンパ性白血病 (ALL)(25歳以下)
・再発・難治性のびまん性大細胞型B細胞リンパ腫 (DLBCL)
ALLでは、キムリア投与時25歳以下で、
*初発の場合:標準的な化学療法を2 回以上施行したが寛解が得られない
*再発の場合:化学療法を1 回以上施行したが寛解が得られない
*同種造血幹細胞移植の適応とならない、または同種造血幹細胞移植後に再発した場合
DLBCLでは、自家造血幹細胞移植の適応とならない、または自家造血幹細胞移植後に再発した場合
*初発の場合:化学療法を2 回以上施行したが完全奏効が得られない、または完全奏効が得られたが再発した場合
*再発の場合:再発後に化学療法を1回以上施行したが完全奏効が得られない、または完全奏効が得られたが再発した場合
*濾胞性リンパ腫が形質転換した場合:通算2 回以上の化学療法を施行し、形質転換後には化学療法を1 回以上施行したが、形質転換後の化学療法により完全奏効が得られなかった、または完全奏効が得られたが再発した場合
上記に該当する場合、以下の紹介フォームをダウンロードし、必要事項をご記載頂き、まずは下記メールアドレスまで、PDFファイルをお送りください
> B細胞性急性リンパ芽球性白血病 (B-ALL) 用紹介フォーム
> びまん性大細胞型B細胞リンパ腫 (DLBCL)用紹介フォーム
※ 本治療法の適応については専門的な判断が必要となるため、適応に関するご相談は主治医の先生のみに限らせていただいております。患者さんやご家族からの問い合わせはお受けしておりませんので、ご了承下さい。
問い合わせ先:
香川大学医学部附属病院 血液内科
MAIL: cart-m@kagawa-u.ac.jp
<参考>
※1 キムリア®
ノバルティスファーマ株式会社が、CAR-T細胞療法として2017年に米国食品医薬品局(FDA)の承認を取得した初めての細胞製剤であり、わが国では2019年3月に厚生労働省の承認を取得した。