蛋白質分解酵素は、蛋白質のプロセッシングを行うのみならず、プロテイナーゼ活性化型受容体(Proteinase-activated receptor:
PAR)と呼ばれる7回膜貫通型受容体を介して細胞作用を発揮し、ホルモン様の作用を発揮します。
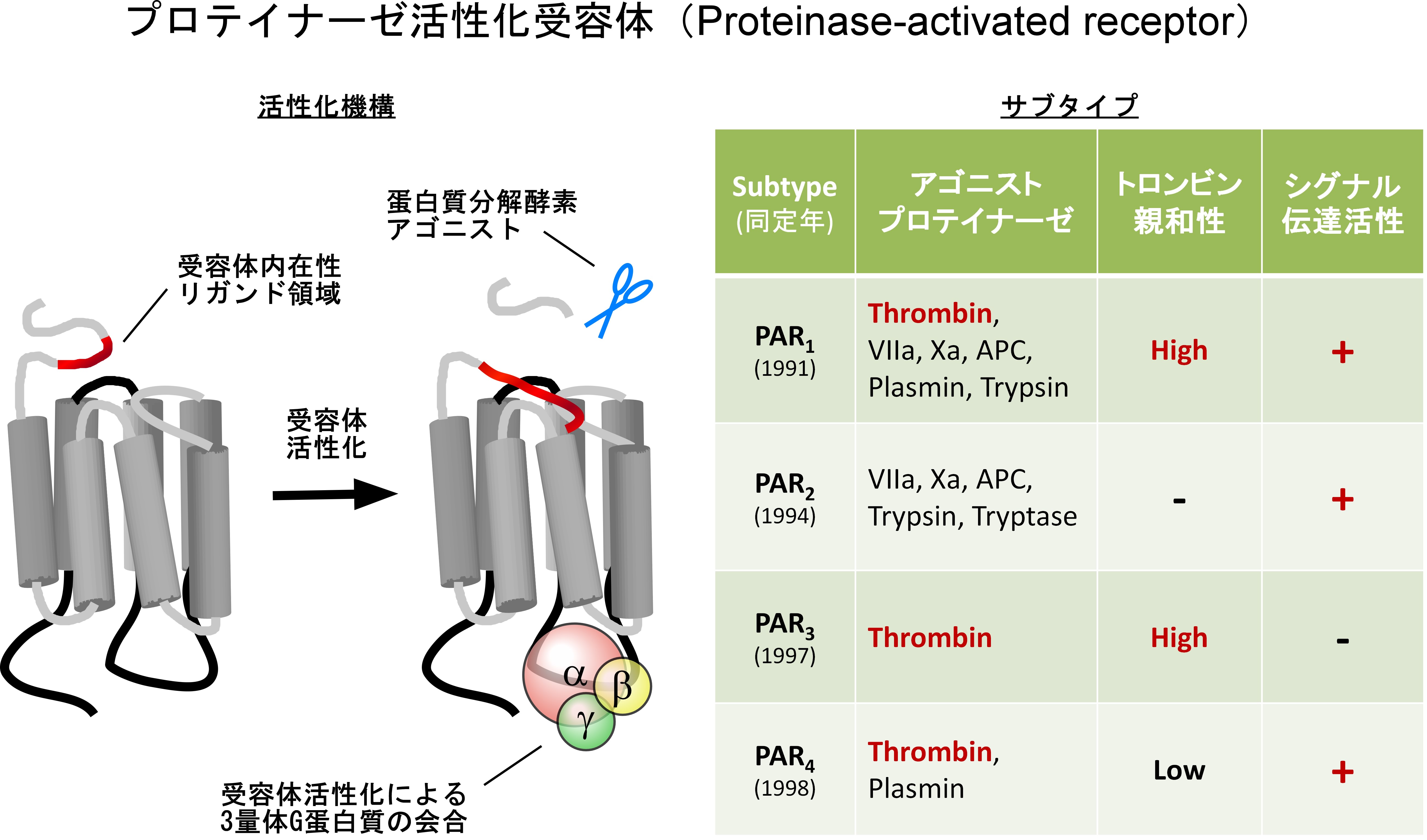
この受容体は特殊な活性化機構を有します(下図)。通常の受容体はアゴニストが結合することによって受容体が活性化されますが、この受容体は、蛋白質分解を受けて活性化されるます。アゴニストである蛋白質分解酵素は受容体の細胞外領域を特定の部位で切断し、その結果新たに生じる断端領域がリガンドとして機能して、受容体を活性化します。
PARには4種類のサブタイプ(PAR1~PAR4)が同定されています。活性化部位を切断する蛋白質分解酵素はすべてアゴニストとして作用することになります。
血液凝固因子の中にはは蛋白質分解酵素をもつものがあります。凝固系と血管壁細胞との相互作用が様々な血管病の病態形成に重要な役割を果たすことが知られています。PARはこの相互作用を担う最も重要な分子であると考えられます。凝固因子トロンビンに対しては、PAR1、PAR3、PAR4が受容体として働きます。PAR1とPAR3が高親和性受容体、PAR1とPAR4がシグナル伝達活性を有する受容体です。従って、PAR1が主要なトロンビンシグナル伝達受容体と考えられます。一方、消化酵素であるトリプシンはPAR2を活性化することが知られています。これ以外にも多くの蛋白質分解酵素がPARのアゴニストとして作用することが明らかにされています。
血管病の成り立ちにおけるPARの役割を明らかにすれば、新たな治療法の開発につながると考え、現在、血管系を中心にPARの生理学、病態生理学研究を行っています。
(1)体循環系正常血管における内皮依存性血管弛緩反応
正常の血管を摘出して、収縮反応を観察すると、トロンビン、トリプシン、プラスミンなどが内皮依存性血管弛緩反応を引き起こすことを明らかにしています。血管によっては内皮依存性収縮反応が生じることも見出しています(ブタ腎葉間動脈)。血管弛緩反応のメカニズムは、血管の種類と用いたアゴニストによって異なります。
トロンビンにはPAR1を介した平滑筋収縮作用が報告されていますが、これまでに私たちが研究を行った多くの体循環系正常血管では、平滑筋の収縮反応を観察したことはありません。
従って、正常血管におけるトロンビンの作用は、内皮作用が主体であり、平滑筋作用は限られた血管において認められると考えられます。
私たちの考え方は、PAR1の発現を解析した他の研究からも支持されています。すなわち、ヒトの正常動脈ではPAR1は内皮細胞だけに発現し、動脈硬化が進行した血管の病変部では平滑筋細胞に発現が誘導されているとしています。
Hirano. Arterioscler Thromb Vasc Biol 27(1): 27-36, 2007より改訂して引用
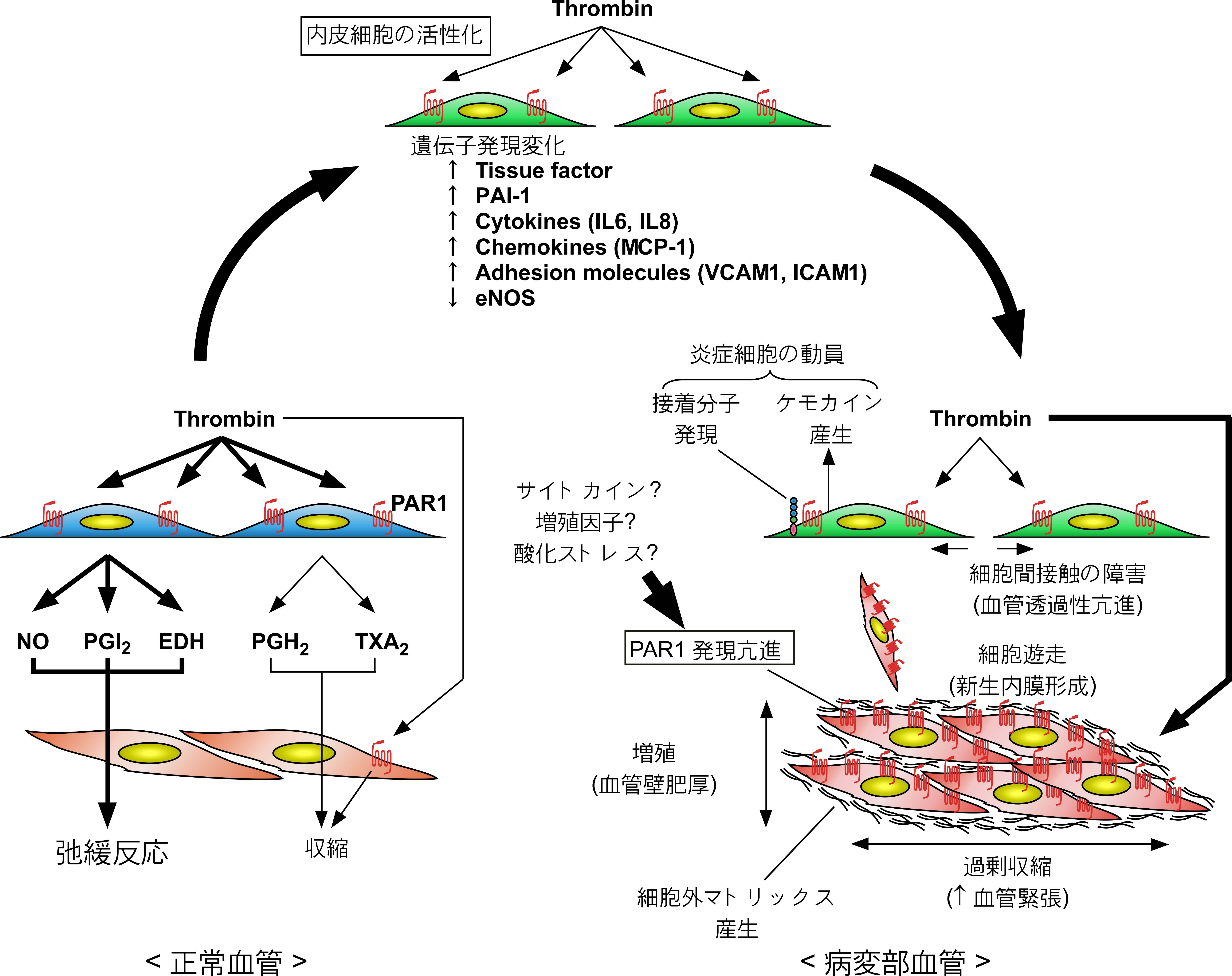
(2)血管病におけるトロンビン受容体の発現亢進と脳血管攣縮における役割
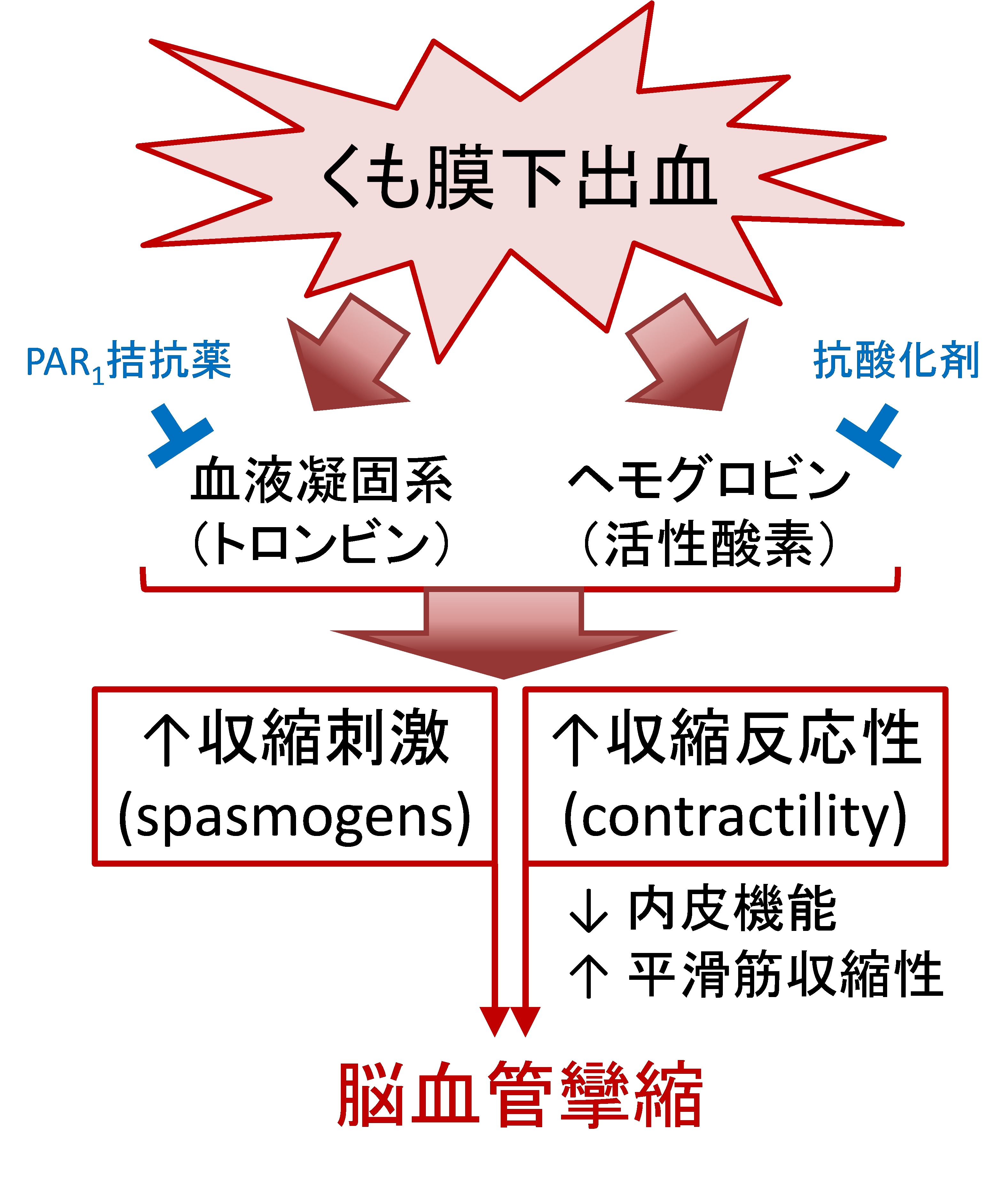
私たちは、ルーン血管傷害モデルおよびクモ膜下出血モデルにおいて、正常ではトロンビンに対して収縮反応を示さない血管においてPAR1の発現が亢進し、トロンビンに反応して収縮するようになることを明らかにしました。さらに、クモ膜下出血モデルにおいては、受容体の活性を負に制御する仕組みが酸化ストレスにより障害され、その結果、一旦トロンビンによって引き起こされた脳血管収縮が刺激を止めても不可逆的に持続することを見出しました(下図)。
クモ膜下出血後の脳血管攣縮は不可逆的に続く血管の異常収縮現象であり、クモ膜下出血患者の生命予後を左右する重大な合併症です。出血が起こると、凝固因子であるトロンビンとヘモグロビン由来の活性酸素が大量に生じます。私どもの研究結果からは、脳血管攣縮の発症機序の根本にトロンビン受容体の発現亢進と不活性化機構の障害が重要な役割を果たすことが示唆されます。事実、トロンビン受容体拮抗薬や抗酸化剤を投与しておくと、受容体の発現亢進や不活性化機構の障害を予防でき、トロンビンに対する過剰収縮反応を抑制することを明らかにしています。
(3)トロンビン反応性に関する肺循環系の特殊性と肺高血圧症との関連
肺循環系の動脈は、体循環系の動脈と異なる性質を有することが知られています。例えば、低酸素は、体循環動脈を弛緩させるのに対して、肺動脈を収縮させます。私たちは、トロンビンに対する反応性に関しても両者が異なることを見出しました。
体循環系の多くの正常動脈においてトロンビンは収縮などの平滑筋作用を発揮しないのに対し、肺循環系では、正常であってもトロンビンは収縮作用を発揮することを見出しました。この収縮には、カルシウム依存性の典型的な平滑筋収縮機序のみならず、酸化ストレスが関与する非典型的な収縮機序が関与することも明らかにしています。
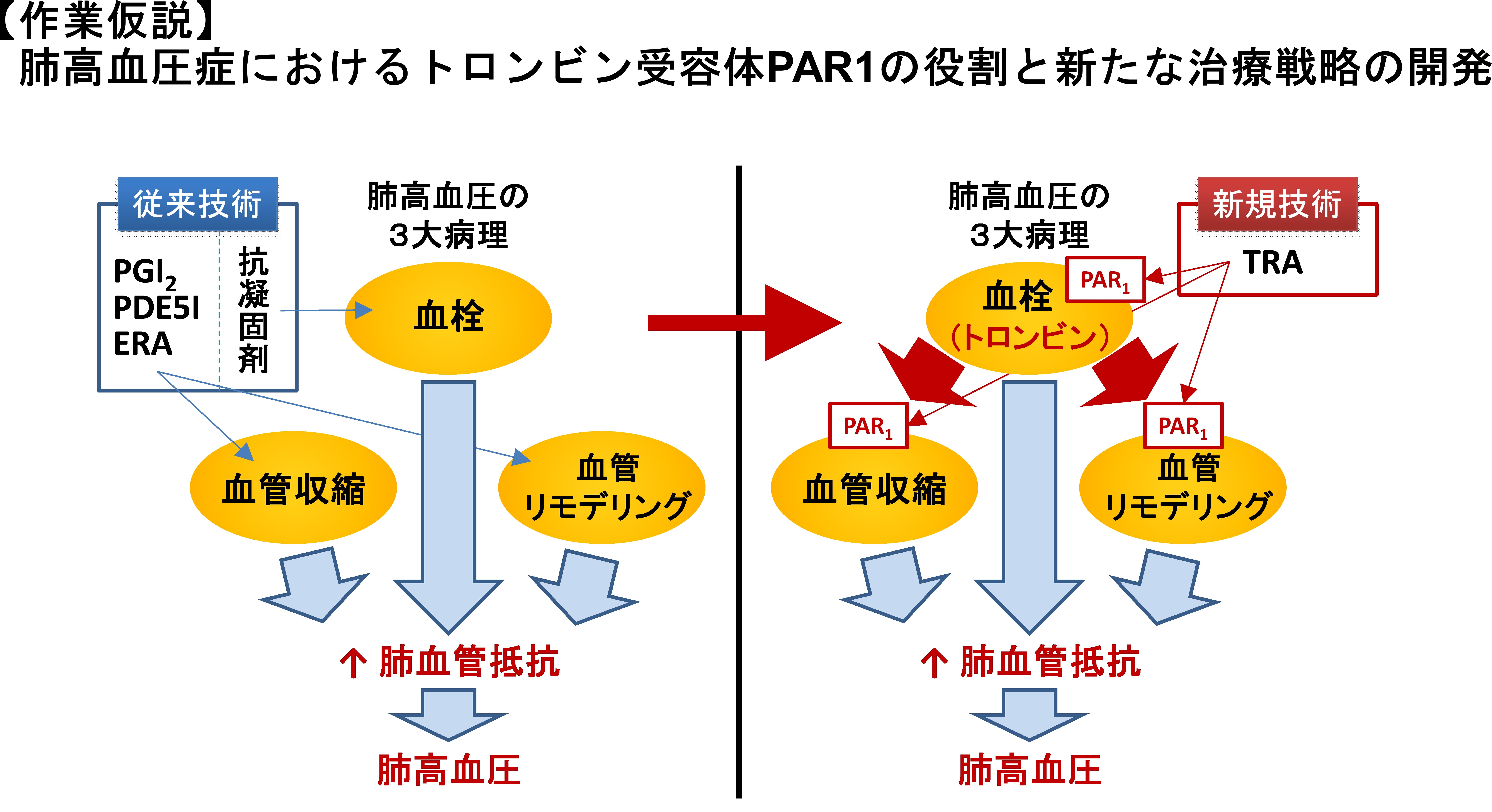
肺動脈の収縮と狭窄によって肺動脈圧が症状する肺高血圧症と呼ばれる難治性の血管病があります。肺血管抵抗の上昇が病態の基盤にあり、これには、血管収縮、血管リモデリング、血栓形成が重要な役割を果たします。肺高血圧症においては凝固系の亢進が報告され、一方、抗凝固薬には予後改善効果があります。私たちが明らかにした肺循環系の特性と、肺高血圧症における凝固系の役割を考え合わせると、トロンビンとその受容体PAR1が肺高血圧症の発症に重要な役割を果たすことが示唆されます(下図)。現在、この仮説を証明し、新たな肺高血圧治療薬の開発を目指す研究を行っています。
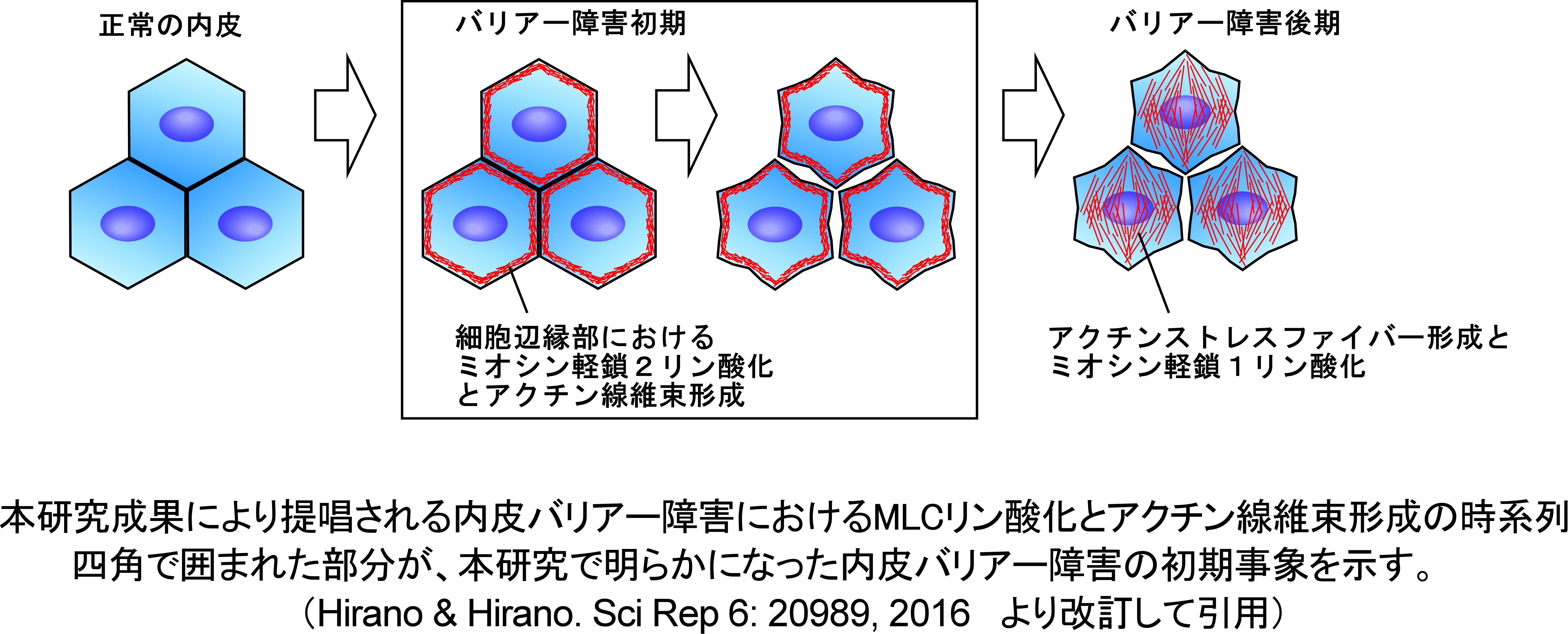
(4)トロンビンが引き起こす内皮バリアー障害
血管内皮細胞は血管の内腔を一層に覆う細胞で、血管の透過性を制御しています。この内皮バリアー機能の障害は血管病の初期病態形成に重要な役割を果たします。
トロンビンはバリアー障害を引き起こす強力な刺激となることが知られています。私どもは、内皮バリアー障害において、細胞辺縁部におけるミオシン軽鎖の2リン酸化とアクチン線維束形成が初期事象として重要な役割を果たすことを見出しました(下図)。
ミオシン軽鎖は2か所でリン酸化されることが知られていましたが、1リン酸化と2リン酸化の機能分担には不明な点がありました。また、バリアー機能が障害されるとき、アクチンは細胞内を貫くストレスファイバーと呼ばれる線維構造を形成するとされていました。私たちの研究から、ストレスファイバー形成に先立って、細胞辺縁部にミオシン軽鎖の2リン酸化によってアクチン線維束が形成されることが明らとなり、従来見落とされていたバリアー障害の初期事象を明らかにすることができました。
(5)新たなアゴニストの探索
凝固因子も含め細胞には多様な蛋白質分解酵素が発現しています。PARのアゴニストとして機能することが不明の酵素もまだ多く存在します。PARのアゴニストとして作用するかどうか、どのサブタイプを活性化するのかについて、PARのサブタイプの遺伝子を欠損させた細胞やノックアウトマウスを用いて研究を進めています。
(6)トロンビン受容体PAR1欠損マウスの病態解析
PAR1は、神経系、心血管系、血液細胞、腎尿路、消化管、生殖器など全身の様々な臓器組織に発現しています。トロンビンが活性化される状況は病的な状況であり、PAR1はそれぞれの場において病態形成に重要な役割を果たすことが示唆されます。現在、PAR1欠損マウスを用いて、炎症や凝固、出血が関与すると思われる様々な病態においてPAR1の役割を明らかにする研究を進めています。これまでに実績のあるクモ膜下出血後脳血管攣縮におけるPAR1の役割を明らかにするとともに、脂肪組織、中枢神経系、腎臓などの未開拓領域の病態における役割についても解析を進めています。PAR1が病態形成に重要な役割を果たす疾患を明らかにすることによって、PAR1を標的とした新たな予防治療法の開発を目指します。