平滑筋は、血管、消化管、気道、膀胱、子宮などの壁に存在し、これらの臓器器官の収縮を調節する筋肉細胞です。これ以外にも、眼の虹彩の大きさを調節する瞳孔散大筋、瞳孔括約筋、水晶体の屈折率を調節する毛様体筋、皮膚の立毛筋も平滑筋に属します。
平滑筋も骨格筋も心筋も、筋肉の収縮は、収縮蛋白質であるミオシンとアクチンの相互作用によって発生します。いずれの筋肉でも細胞内のカルシウム濃度によってミオシンのATP加水分解酵素(ATPase)活性が制御され、収縮が引き起こされます。しかしながら、カルシウムによるミオシンATPase活性の調節の仕組みが、横紋筋(骨格筋と心筋)と平滑筋とでは異なります
平滑筋において、収縮刺激によって細胞質のカルシウム濃度が上昇すると、カルシウムはカルモジュリンに結合し、ミオシン軽鎖リン酸化酵素(MLCK:
myosin light chain kinase)を活性化します。その結果、ミオシン軽鎖の19番目のセリンおよび18番目のトレオニンがリン酸化され、ミオシンATPase活性が上昇し、平滑筋が収縮します。一方、収縮刺激が止み、カルシウム濃度が低下すると、ミオシン軽鎖脱リン酸化酵素(MLCP:
myosin light chain phosphatase)によってミオシン軽鎖は脱リン酸化し、平滑筋は弛緩します。
(1)平滑筋収縮装置のカルシウム感受性変動の発見(研究開始:1987年~)
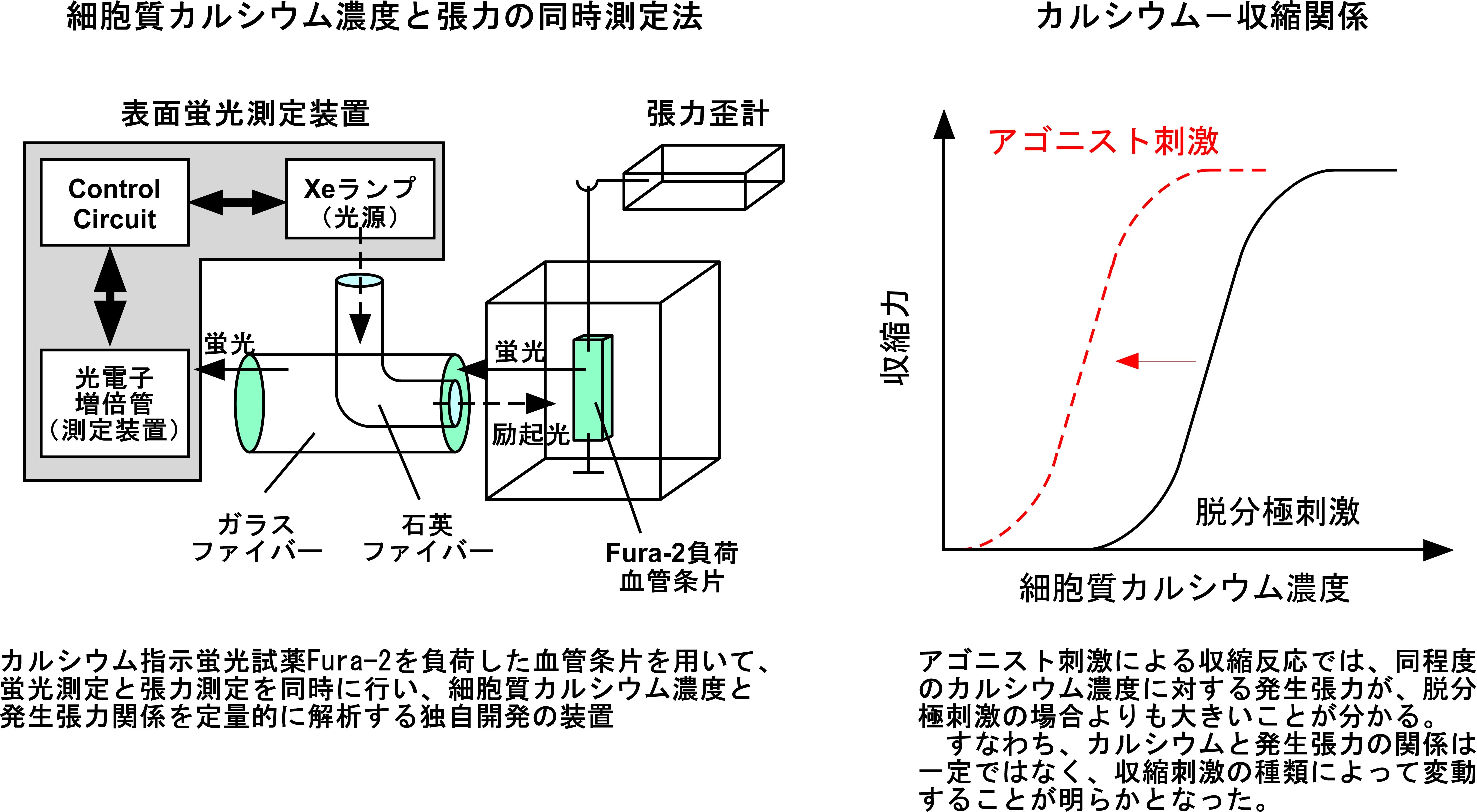
平滑筋収縮が細胞質のカルシウム濃度だけで決定されるのならば、カルシウム濃度と収縮の関係は収縮刺激が違っても一定であると予想されます。1989年、カルシウム指示蛍光色素Fura-2を取り込ませた平滑筋組織から、細胞質カルシウム濃度と収縮を同時に記録する技術を開発し(下図)、両者の関係を様々な収縮刺激で比較してみると、カルシウム濃度と収縮の関係は刺激の種類によって異なることが明らかとなりました。通常、細胞膜の脱分極刺激による収縮の場合と比べて、7回膜貫通型受容体の刺激による収縮の場合、同程度のカルシウム濃度に対して発生する収縮が大きくなります。この現象を、収縮装置のカルシウム感受性の増強と呼んでいます。
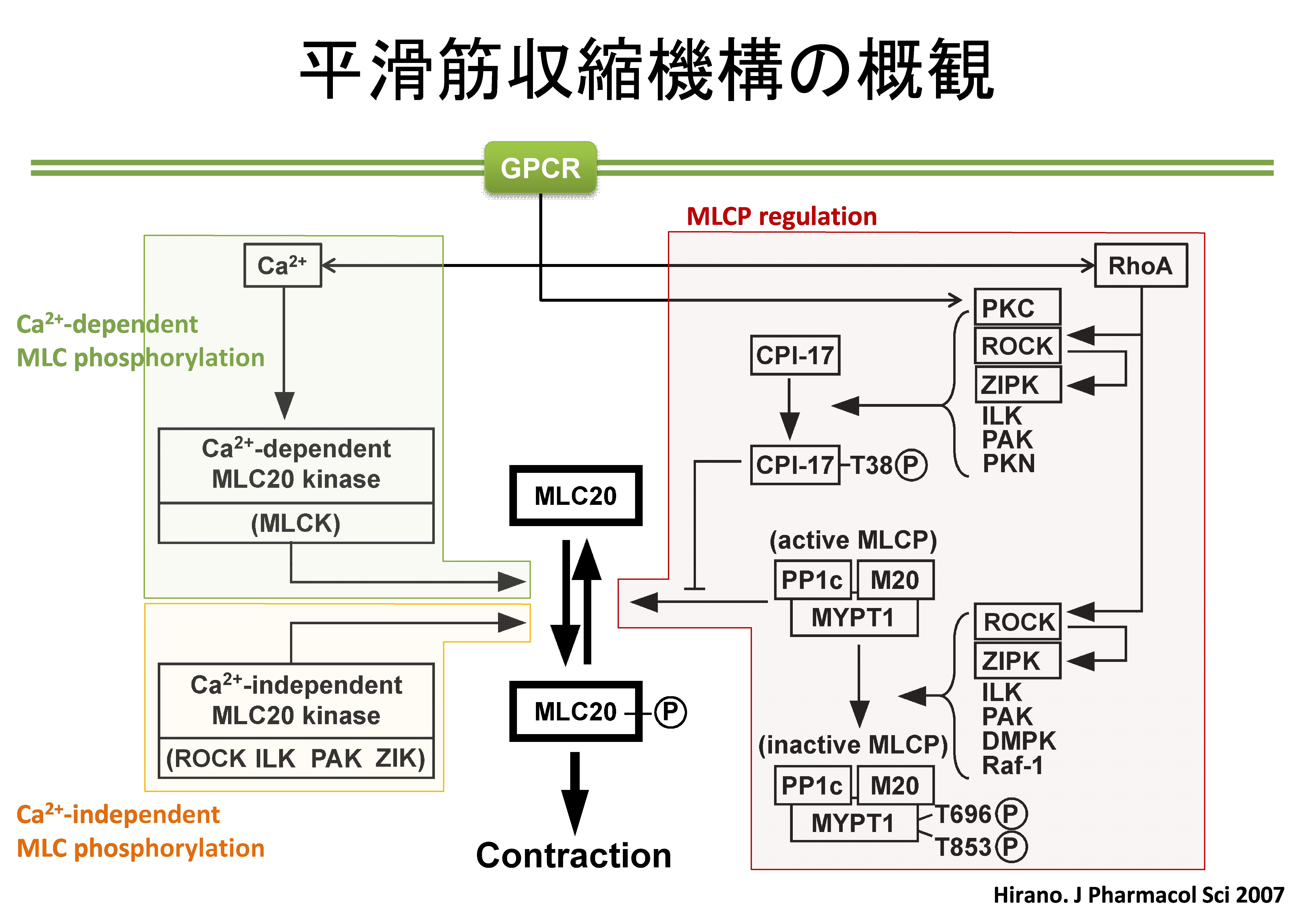
カルシウム感受性の調節機構は、1990年半ばから2000年初めにかけての研究で詳細が明らかにされています。平滑筋収縮の分子機構の現在の理解をまとめたものが次の図です。カルシウム感受性の調節には、ミオシン軽鎖脱リン酸化酵素
(MLCP)の活性調節が重要な役割を果たします。リン酸化酵素の活性に対して脱リン酸化酵素の活性が低下すると、カルシウム感受性は増強し。脱リン酸化酵素の活性が低いとカルシウム感受性が低下します。
図において、Ca2+-dependent MLC phosphorylationとしている部分がカルシウム依存性の古典的な収縮機構を示します。MLCP
regulationとしている部分が感受性調節に重要な役割を果たすMLCPの活性を調節する仕組みです。MLCPの活性は、その構成要素であるMYPT1と呼ばれる蛋白質がリン酸化(T696、T853)を受けると低下します。また、CPI-17と呼ばれる脱リン酸化酵素阻害蛋白質によっても抑制されます。CPI-17はリン酸化されて初めて脱リン酸化酵素阻害蛋白質としての機能を発揮することができます。アゴニスト刺激から、MYPT1やCPI-17のリン酸化に至るシグナル伝達経路も明らかにされています。Ca2+-independent
MLC phosphorylationとしている領域は、活性がカルシウムに依存しないリン酸化酵素によるミオシン軽鎖のリン酸化の経路を示します。この経路が活性化されるとカルシウム感受性が増強することになります。
平滑筋収縮に及ぼす薬物の作用は、カルシウム濃度に影響を及ぼすか、収縮装置のカルシウム感受性に影響を及ぼすことによって、平滑筋を収縮させたり、弛緩させたりすると理解できます。高血圧や狭心症の治療に用いられるカルシウム拮抗薬は、カルシウム感受性には影響を与えずに、細胞質カルシウム濃度を低下させることによって血管を弛緩させることを明らかにしています。一方。狭心発作の治療薬であるニトログリセリンや喘息治療薬のテオフィリン、β2受容体刺激薬は、カルシウム感受性を低下させることが平滑筋の緊張を和らげる主な機序となっています。
(2)ミオシン軽鎖脱リン酸化酵素の同定、機能解析(研究開始:1993年~)
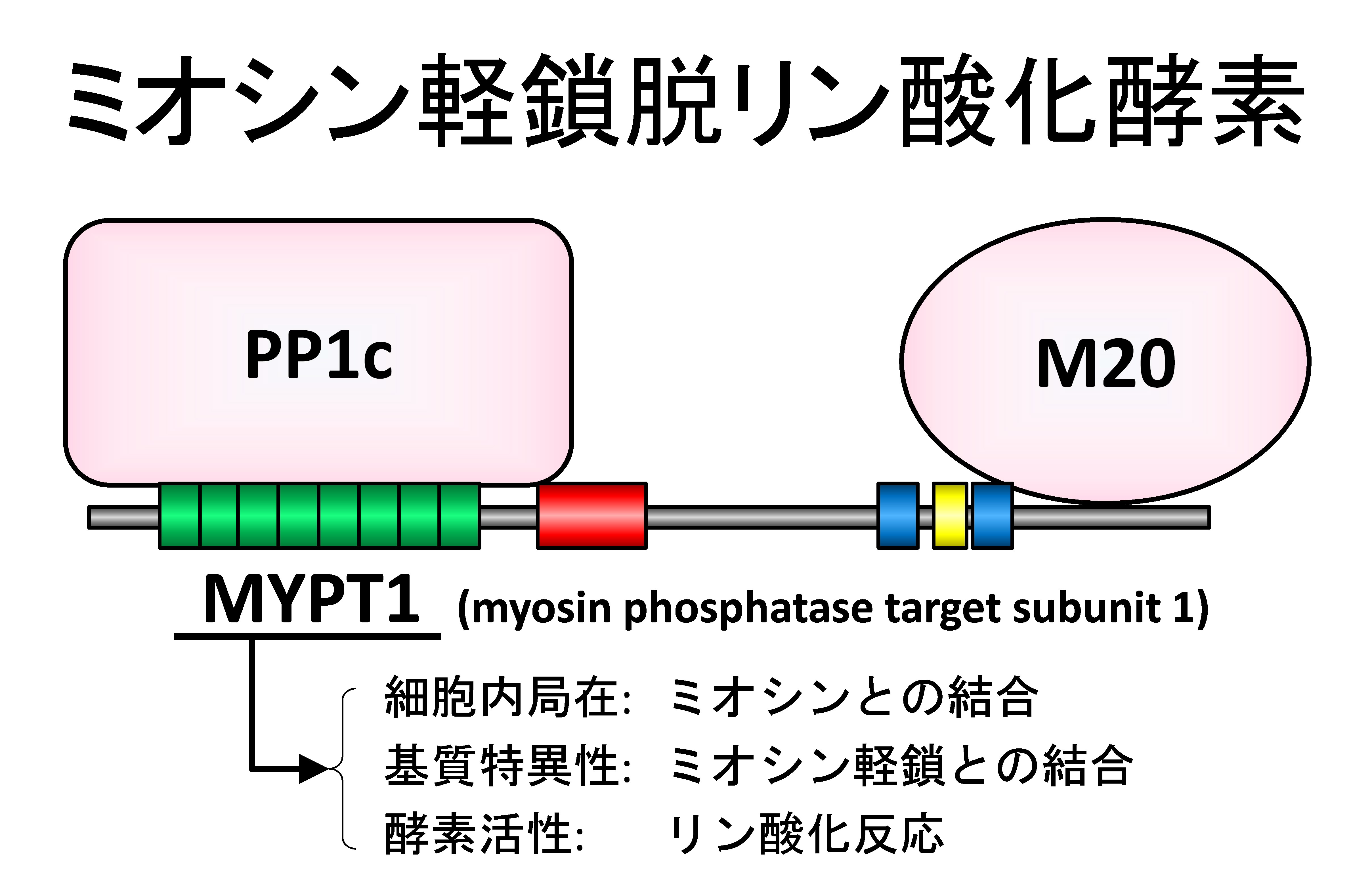
1994年、カルシウム感受性の調節に重要な役割を果たす平滑筋ミオシン脱リン酸化酵素の世界初のクローニングに従事し、触媒サブユニットPP1cと2つの調節サブユニットMYPT1とM20からなることを明らかにしました。
蛋白質相互作用の解析技術である酵母ツーハイブリッド法を用いて3つのサブユニットの構成を明らかにし、MYPT1のN末端領域にPP1cが、C末端領域にM20が結合することを明らかにしました(下図)。さらに、MYPT1とPP1cの結合の詳細を明らかにし、現在KVxFモチーフとして知られるPP1c結合モチーフの確立に貢献しました。
MYPT1が実際に平滑筋のカルシウム感受性調節に関与することは、細胞膜の透過性を高めた脱膜化平滑筋標本や、細胞膜を通過して細胞内に侵入する能力のあるペプチド(細胞侵入性ペプチド)を用いた蛋白質細胞内導入技術をもちいて、MYPT1の各種フラグメントを導入し、平滑筋収縮への影響を解析することによって明らかにしました。
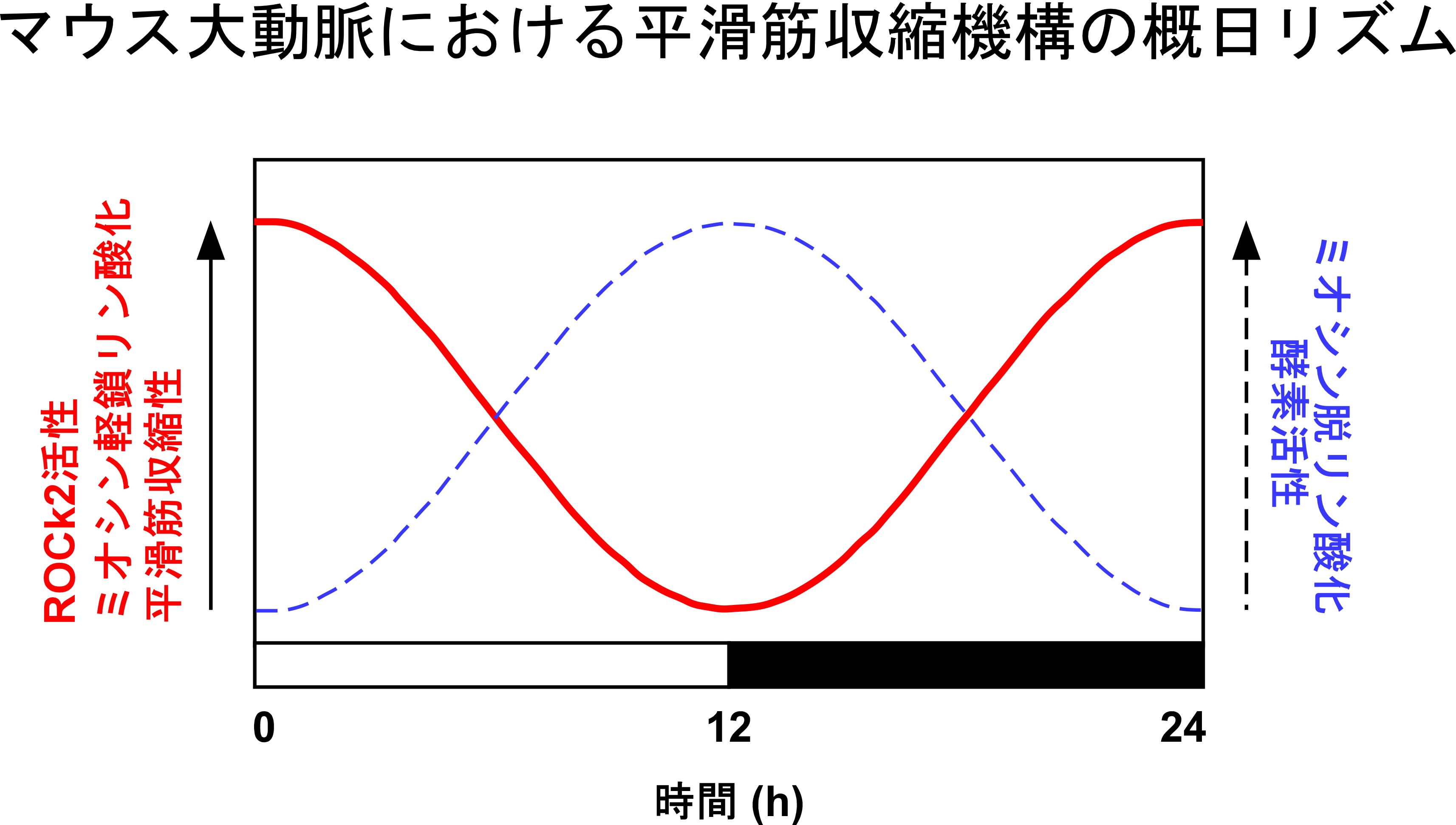
(3)血管内在性生物時計による平滑筋収縮性の日内リズム形成機構(研究開始:2007年~)
血圧は日内リズムを刻むことが知られています。狭心症発作や心筋梗塞の発生にも日内変動が知られています。これら循環器系に認められ日内リズムの発生には、交感神経系の活動、内皮機能、凝固線溶系活性、血小板機能に加え、血管収縮性の日内リズムが関与します。
視床下部と呼ばれる脳の領域にある視交叉上核が、生体の日内リズムを昼夜の環境変動に同調させる中枢時計と機能します。一方、末梢組織にも内在性の時計、抹消時計が存在します。従って、末梢組織の日内リズムは、中枢時計からの指令と自身の時計の相互作用によって調節されると考えられます。
血管収縮性の日内リズムを形成する血管内在性生物時計の存在とその仕組みについては不明な点が多く残されていましたが、私たちは、この血管内在性生物時計の仕組みを明らかにすることに成功しました。
培養血管平滑筋細胞を用いて、ミオシン軽鎖リン酸化が日内リズムを刻むことを見出しました。このリン酸化のリズムは、平滑筋細胞に発現する時計遺伝子RORαによって、ROCK2と呼ばれるリン酸化酵素のリズムが生じ、MYPT1のリン酸化が日内変動し、ミオシン脱リン酸化酵素活性が日内リズムを刻むことによって生じることを見出しました。培養平滑筋細胞を用いた明らかにした時計のシステムが生体においても機能していることを、RORαを自然に欠損するStaggererマウスを用いて明らかにしました。明期のはじめにROCK活性、ミオシン軽鎖リン酸化レベルが高く、収縮性が高まり、暗期のはじめに低くなることを見出しました。マウスは夜行性であり、私たちが明らかにした仕組みが、昼行性であるヒトでどのような役割を果たすかは今後の課題として残されています。