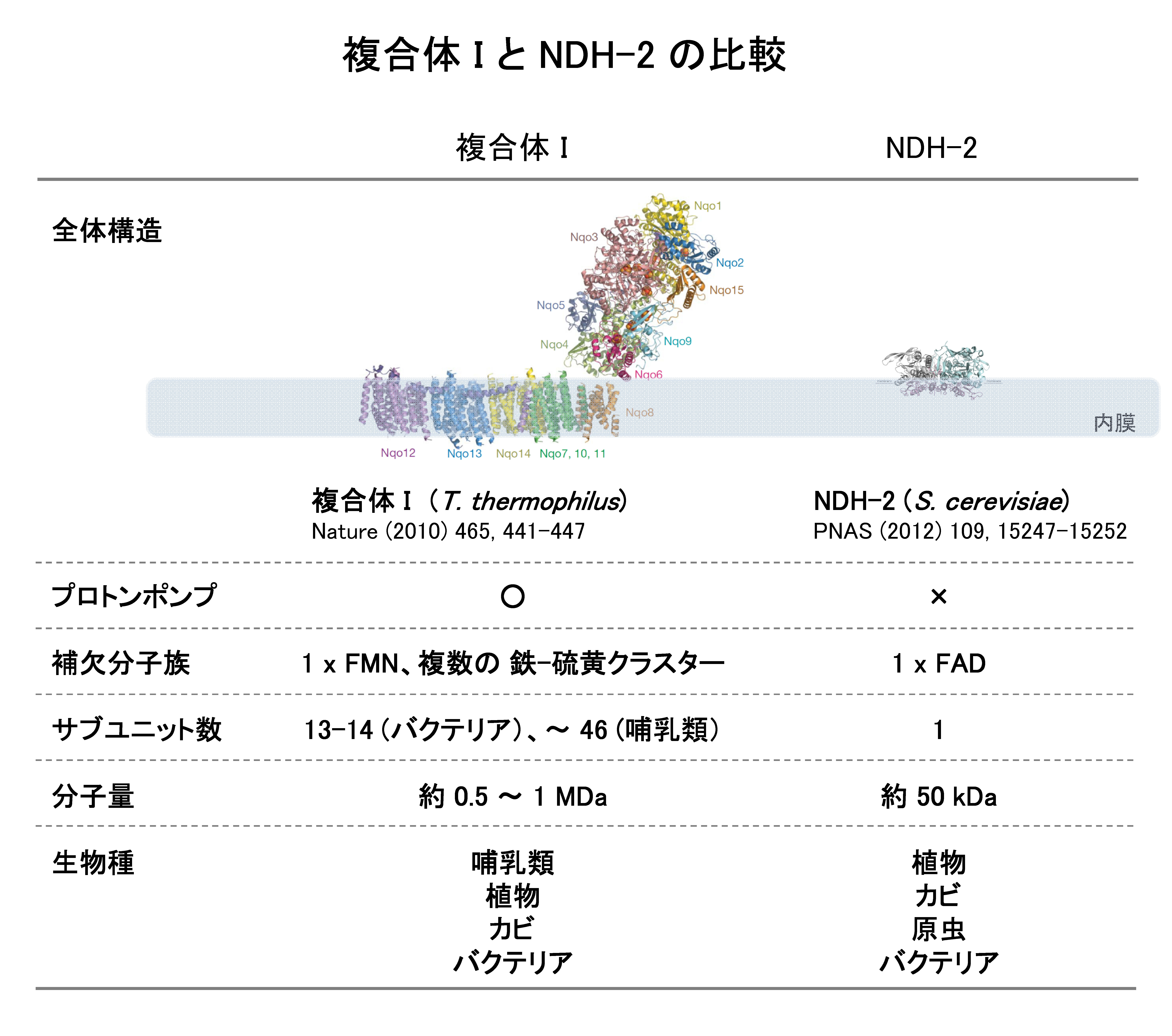
エネルギー生成系で機能するNADH脱水素酵素(NADH-ユビキノン酸化還元酵素)には、呼吸鎖複合体IとNDH-2の2種類が存在します。両酵素はともにNADHからユビキノンへの電子伝達を触媒していますが、サブユニット構成、補欠分子族、プロトンポンプの有無といった構造および機能に大きな差異があります。
NDH-2は植物、原虫、細菌など多くの生物種に存在しています。その中には年間2億人以上が罹患し死亡者数が200万人を超えるマラリア原虫(WHO: World Malaria Report 2011)や、結核菌などが含まれます(Microbiol. Mol. Biol. Rev., 2004, 68, 603-616)。NDH-2はプロトンポンプの機能がないためエネルギー産生に直接関与しませんが、細胞内NADHの再酸化に重要や役割を果たし、NDH-2を欠損したマラリア原虫や結核菌は増殖抑制や致死性を示すことが報告されています(J. Biol. Chem., 2011, 286, 32661-32671、Microbiol., 2002, 148, 2975–2986)。
一方、これら病原体の宿主となる哺乳類にはNDH-2が存在しないことから、NDH-2に対する特異的阻害剤はマラリア原虫や結核菌に対する選択性が高い新規治療薬になると期待されています(Infect. Disord. Drug Targets, 2007, 7, 169-181)。現在、NDH-2を分子標的とした阻害剤の探索が精力的に行われており、オーラシン誘導体がマラリア原虫を含む多くの生物種のNDH-2を低濃度で阻害すると報告されています(J. Med. Chem., 2012, 55, 1831-1843)。しかし、オーラシン誘導体は哺乳類に存在する呼吸鎖複合体IIIの強力な阻害剤でもあるため(IC50 = 43 nM)、NDH-2に対するより選択性の高い阻害剤の開発が望まれています。
選択性の高い著効性阻害剤を開発するためには、NDH-2の反応機構とその構造的基盤の理解の上に、タンパク質と阻害剤との相互作用を分子レベルで明らかにする必要があると考えられます。
(1)NDH-2の反応機構 ・結晶構造解析・ユビキノン結合部位の同定
私どもは、酵素活性が非常に高く、安定で、かつ大量調整が容易な「出芽酵母NDH-2」を用いて変異体や生成物を用いた反応速度論的解析を行い、NDH-2の酵素反応が「酵素-NADH-ユビキノン三者複合体」の形成を介して進行することを明らかにしています(J. Biol. Chem., 2007, 282, 6012-6020、Biochemistry, 2010, 49, 2973-2980、J. Biol. Chem., 2011, 286, 9287-9297)。
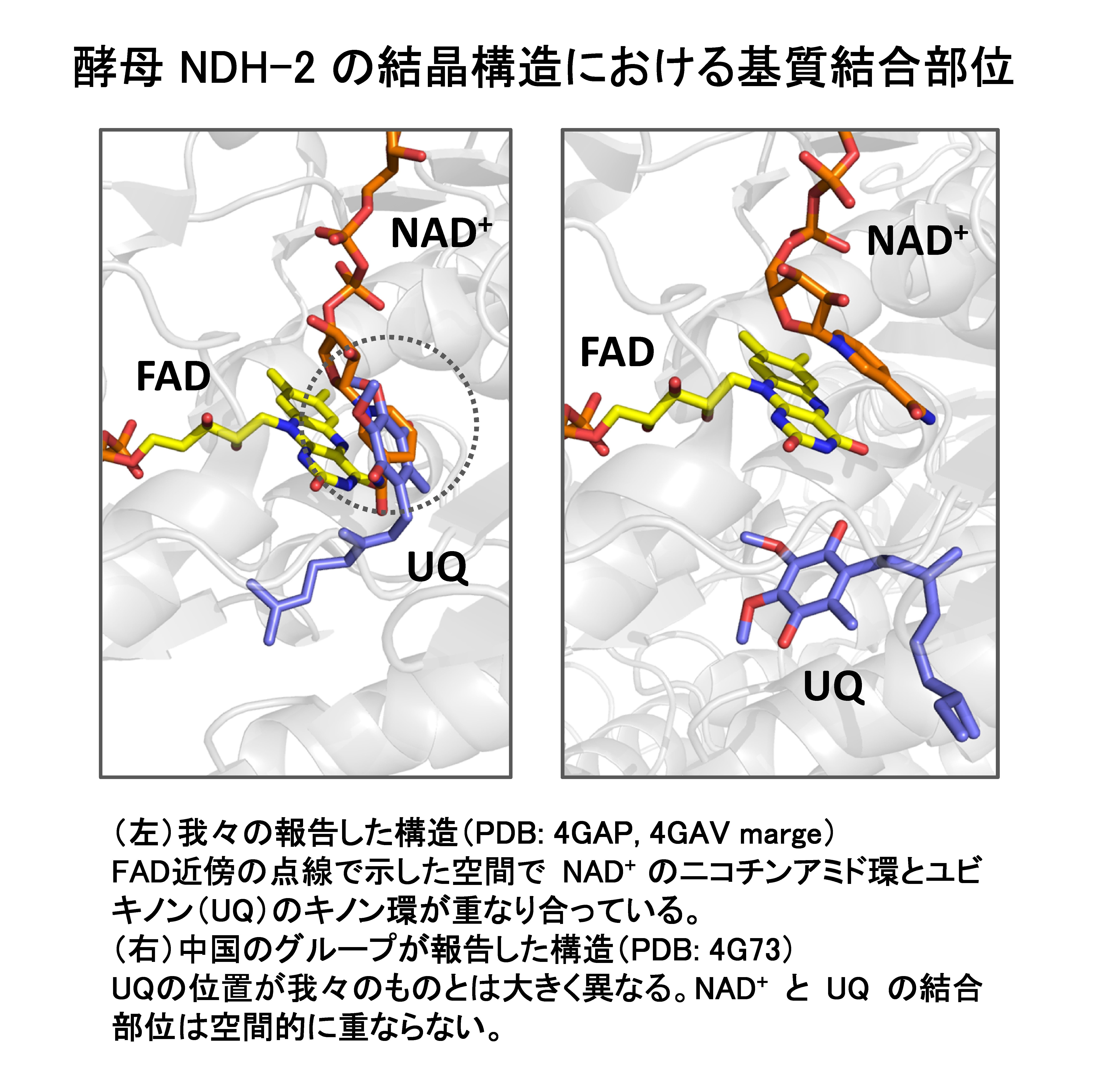
2012年には、英国Imperial College岩田想教授との共同研究により酵母NDH-2の単結晶構造および両基質との共結晶構造を初めて明らかにしました(Proc. Natl. Acad. Sci. U. S. A., 2012, 109, 15247-15252)。同時期に中国のグループも、同じ酵母NDH-2の結晶構造を報告しています(Nature, 2012, 491, 478-82)。彼らの解析結果と私たちの解析結果において基質ユビキノンの結合部位が大きく異なっており、ユビキノンの生理的な結合部位については今後のさらなる研究が必要です。
現在、NDH-2のより詳細な反応機構とその構造的基盤を理解するため、「ユビキノン結合部位」および「FADからユビキノンへの電子伝達反応機構」を構造生物学的および生化学的手法を用いて解析中です。
具体的には、① ユビキノン還元部位を標的とした阻害剤のライブラリーからNDH-2に対して強い阻害活性をもつ化合物を探索し、ユビキノンに対する阻害様式を決定する計画です。② 阻害剤とNDH-2との共結晶を作製し、結晶構造解析によってタンパク質と阻害剤との相互作用を分子レベルで明らかにすることも計画しています。この際、構造中における阻害剤の結合位置とユビキノンに対する阻害様式から本来のユビキノン結合部位を決定します。さらに、③ すでに得られている結晶構造を参考に、ユビキノンのキノン環の近傍に位置するアミノ酸残基を中心に部位指定変異体を作成し、反応速度論的解析によって、「ユビキノンと相互作用するアミノ酸残基」および「FADからユビキノンへの電子伝達に関係するアミノ酸残基」を同定します。
以上の研究により、NDH-2のユビキノン還元反応の分子機構を明らかにしたいと考えています。