プログラム細胞死は、基本的な生命現象に重要な役割を果たしているだけでなく、多くの疾患の発症に深く関わっていることが明らかとなっています。このプログラム細胞死を分子レベルで解明する研究が1990年代から精力的に進められ、特にカスパーゼ依存性アポトーシスにおいて細胞死を司る分子およびそれらの分子の制御機構が解明されてきました。この一連の研究の中で、ヒト子宮頸癌細胞株(HeLa細胞)の単離核をアポトーシス様へと変化させる活性を持つタンパク質としてApoptosis Inducing Factor (AIF) が発見されました(Nature, 1999, 397, 441-446)。
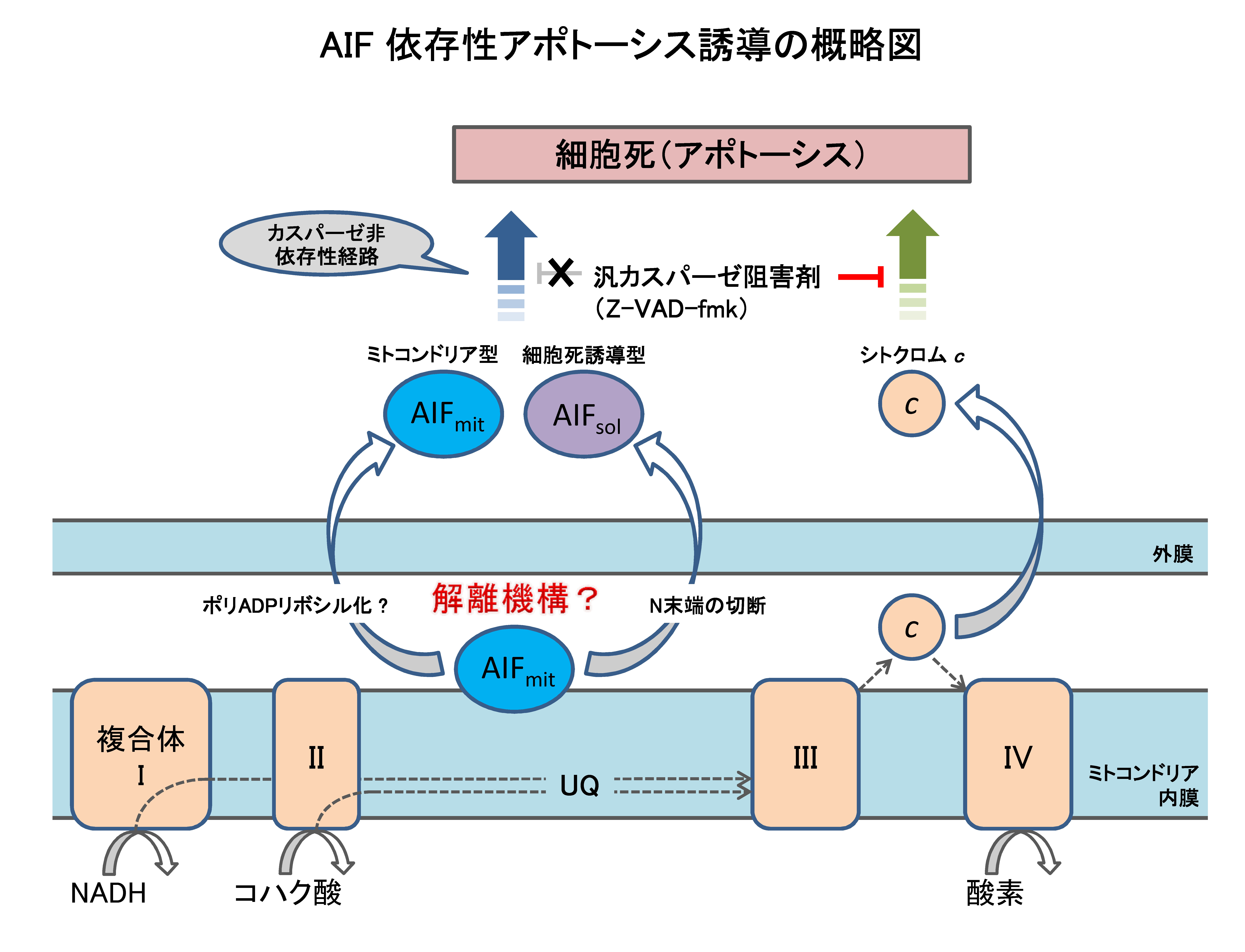
AIFは細胞死を誘導する際に、カスパーゼを活性化するシトクロムcと同じくミトコンドリアから放出され、核に移行してDNAの凝集化および断片化に関与することが明らかとなっています(FEBS lett., 2000, 476, 118-123)。しかし、AIFが原因で引き起こされるアポトーシスは、カスパーゼ阻害剤(Z-VAD-fmk)の添加によって回避できないため、AIFはカスパーゼ非依存性にアポトーシスを誘導すると考えられています。また、神経細胞においてミトコンドリア呼吸鎖から生成する過酸化水素が原因で起こるアポトーシスでは、シトクロムcによるカスパーゼ3の活性化は起こらず、AIF単独でアポトーシスを誘導することから、AIFとシトクロムcの放出が引き金になるアポトーシスは必ずしも協調的に機能しているわけではないと考えられます(J. Biol. Chem., 2007, 282, 24146-24156)。
AIF依存性アポトーシス誘導にはAIFのミトコンドリアから核への移行が必須ですが、ミトコンドリア膜からの解離の機序は未だ不明な点が多いのが現状です。従来、ミトコンドリアに局在するミトコンドリア型AIF(AIFmit)はN末端の膜貫通領域がプロテアーゼ(μカルパイン)によって限定分解され、可溶性の細胞死誘導型AIF(AIFsol)として膜から解離すると考えられてきました。しかしながら、AIFmitはポリADPリボシル化されることにより、切断によらずに膜から解離する現象も報告されています(Exp. Neurol., 2009, 218, 221–227、 J. Neurochem., 2009, 110, 687–696)。
(1)ミトコンドリアからAIFが放出される分子機構
私たちは、AIF依存性アポトーシスの初期イベントである「ミトコンドリアからAIFが放出される分子機構」を解明する研究を行っています。マウス由来AIF(AIFmitまたはAIFsol)を大腸菌に発現させ、イオン強度とpHを変化させた際の大腸菌膜との結合様式についてウェスタンブロット法を用いて解析しました。菌体を懸濁・破砕する際の緩衝液が低イオン強度(I = 7 mM)の場合、AIFmitは80%、AIFsolは50%程度膜に結合します。一方、高イオン強度下(I = 300 mM)では両酵素とも膜から解離し可溶性画分に移行しますが、浸透圧の影響はほとんど受けないことを明らかにしました。この結果は、AIFの膜への結合はイオン結合に大きく依存していることを示唆してします。
事実、結晶構造からAIFの表面電荷は非常に正電荷が多いことが示されています。そこで、pHを変化させた際の膜への結合能を調べたところ、AIFの正電荷が消えるアルカリ条件下では膜への結合能が顕著に低下することを見出しました。さらに、AIFmitおよびAIFsolのイオン強度変化に対する膜結合への影響を詳しく調べたところ、AIFmitは自身が局在するミトコンドリア膜間腔のイオン強度(I =100-150 mM)において膜に結合したままでしたが、同イオン強度下においてAIFsolの大部分が膜から解離しました。
これらの結果は、AIFと膜との相互作用が上述の従来の考え方(AIFは膜貫通蛋白質であり、N末端領域の限定分解によってミトコンドリア膜から遊離する)とは異なり、AIFは自身の塩基性アミノ酸の正電荷と膜表面のリン脂質の負電荷によるイオン結合を介して膜表面に結合する膜表在性タンパク質であって、N末端の切断はAIFの正電荷を減弱させることにより生体膜との相互作用を低下させることを示唆しています。
現在、AIFのN末端領域の切断が膜結合領域の正電荷をどのように変化させるかについて検討中を進めています。具体的には、AIFへのNADHの結合は2量体形成とミトコンドリアへの膜結合を促進することが示されていることから、NADHの結合および2量体形成におけるN末端領域の役割を明らかにすることを目的としています。さらに、ポリADPリボシル化依存性にAIFが膜から解離する機構についても、組換え蛋白質の再構成系を用いて生理的な条件下で働く仕組みを明らかにしようとしています。