研究内容
医学部の病理学講座としては、病院の臨床部門との共同研究を通じて、将来的に患者さんのお役に立てるような研究成果を目指す必要があります。教室名の分子腫瘍病理学の名の通り、「腫瘍細胞の進展に伴う形態変化や分子機構を解明し、癌の予防や診療の発展に寄与」したいと考えています。
具体的には、テロメアやテロメレースの変化に基づいて発がん機序や加齢の関連性を解明する研究、組織マイクロアレイによる免疫組織化学的解析を用いて腫瘍の悪性度を解明する研究、術前治療後の癌細胞の形態的変化を解析する外科病理学研究、癌幹細胞関連分子を標的とする新規治療薬開発を目指したトランスレーショナルリサーチ、二光子励起顕微鏡によるイメージングに基づく研究、老化細胞の細胞死誘導メカニズムを解明する研究などを教室の主たる研究テーマに掲げています。
香川大学と島根大学の共同研究の枠組みも構築しており、今後も「癌の悪性度を規定する病理学的因子の解明」を大きな研究テーマの一つとして、発展させたいと考えています。
- 機能性RNAによるオートファジー制御機構の研究
- 細胞はアミノ酸枯渇などによる飢餓状態になると、細胞生存のためにオートファジー(自食作用)によってアミノ酸の再利用とエネルギーを補います。その際、細胞内の
VPS34(クラス III PI(3)キナーゼ)の活性化によって生体膜リン脂質 PI(3)P の産生が上昇し隔離膜が形成されます。
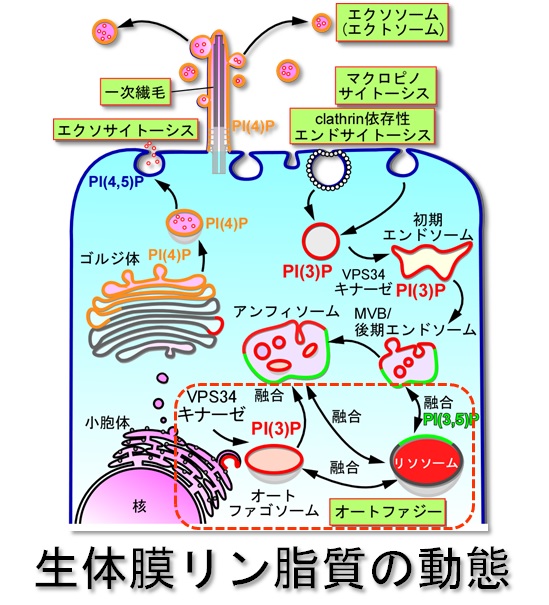 PI(3)Pは、隔離膜の成長に重要なPhafin2や、WIPI (酵母Atg18のホモログ)などを小胞体膜にリクルートするために重要な因子です。(Matsuda-Lenikov,
Suizu et al. PLosOne 2014)
PI(3)Pは、隔離膜の成長に重要なPhafin2や、WIPI (酵母Atg18のホモログ)などを小胞体膜にリクルートするために重要な因子です。(Matsuda-Lenikov,
Suizu et al. PLosOne 2014)
オートファジーの制御破綻によって様々な病気が惹起されることから、私たちは、 PI(3)P を標的として直接オートファジーを制御することによって病気の発症を抑える事を考えています。これまで、 PI(3)P を直接認識しオーファジー活性を阻害する40塩基長のRNAアプタマーを単離し、癌細胞の増殖を抑制することに成功しています。

この結果を基に、より効果的な膜リン脂質認識性の核酸医薬の研究を進めています。 - テロメラーゼ逆転写酵素 (hTERT) のリン酸化が癌細胞の増殖能や悪性度、分化、および予後不良マーカーであることを発見
- これまでテロメラーゼ逆転写酵素 (hTERT) を病理組織検体で正確に調べる方法がなかったため、様々な癌の症例における臨床的な意義は分かっていませんでした。今回の研究では、hTERT
スレオニン 249 のリン酸化を特異的に免疫染色法で検出可能な新しい抗体を作製し、病理組織検体中でのリン酸化 hTERT の発現を調べることに成功しました。
さらに、多施設の 1,523 症例の病理組織検体を用いて免疫染色を行い、リン酸化 hTERT の発現が多い癌では、細胞の増殖能や悪性度が高く、分化度の低い癌であることを明らかにしました。また、肺癌、膵臓癌、肝臓癌では、リン酸化
hTERT の発現が多いと手術後の生存期間が短いことを明らかにしました。このことは、リン酸化 hTERT の免疫染色法は、悪性度の高い癌を調べるための有用な検査法となる可能性を示唆します。
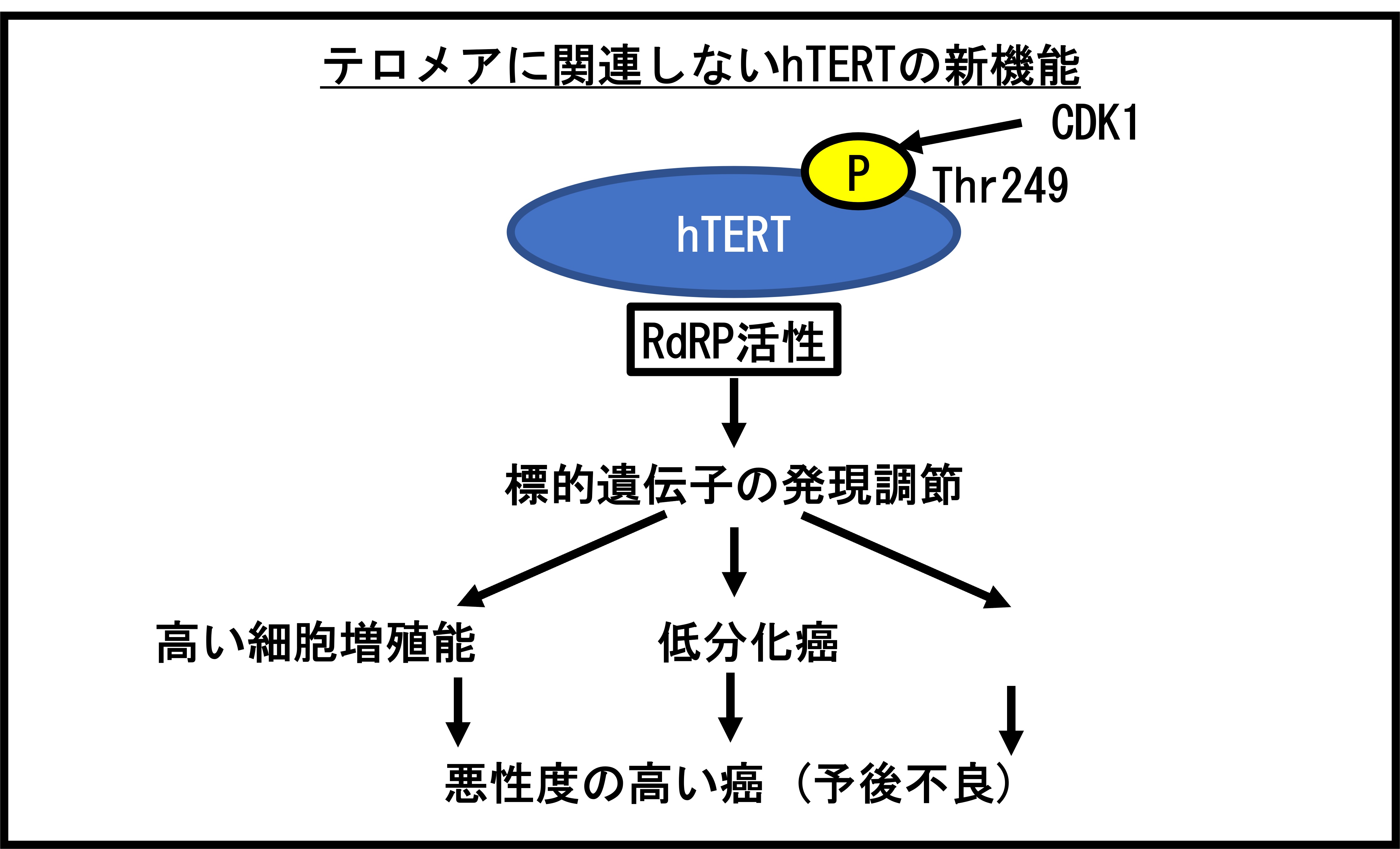
また、本研究により、hTERT のテロメア長制御以外の新しい機能を臨床検体で明らかにできました。今後、リン酸化 hTERT を指標にした癌の新しい診断法の開発が大きく期待されます。
本研究は 2022 年 3 月 23 日にプレスリリースされました。
https://www.kagawa-u.ac.jp/files/3516/4792/6838/News_Release_TERT_PDF_2.pdf(PDF:428KB)
本研究は The Wiley Research Headlines に選ばれました。
参考文献: Matsuda Y, Yamashita T, Ye J, Yasukawa M, Yamakawa K, Mukai Y, Machitani M, Daigo Y, Miyagi Y, Yokose T, Oshima T, Ito H, Morinaga S, Kishida T, Minamoto T, Yamada S, Takei J, Kaneko K M, Kojima M, Kaneko S, Masaki T, Hirata M, Haba R, Kontani K, Kanaji N, Miyatake N, Okano K, Kato Y, Masutomi K. Phosphorylation of hTERT at threonine 249 is a novel tumor biomarker of aggressive cancer with poor prognosis in multiple organs. The Journal of Pathology 2022 Epub ahead of print. - 術前治療後の膵癌切除病理検体の病理組織学的評価
the Pancreatobiliary Pathology Societyの推奨 - 膵癌は 5 年生存率約 10%と極めて予後不良である。近年、術前に放射線化学療法を行うことで、原発巣の縮小や微小転移の予防が期待でき、予後改善に結び付くことが報告されている。しかし、膵癌の術前治療後の病理組織学的評価に関するガイドラインは未だ確立されていない。
この問題を解決するため、アメリカの the Pancreatobiliary Pathology Society は、2018 年に術前治療の肉眼的評価方法や文献、問題点の探索に関する委員会を設立し、松田は委員会に所属している。
委員会は次のような点を推奨する:
- 系統的、標準化された肉眼的評価と検体採取
- 肉眼的な腫瘍の最大割面で、腫瘍の大きさやその他の肉眼所見を評価し、この部のサンプリングを連続的に実施 (マッピング)
- 生存している癌細胞の外周を評価し、腫瘍の大きさを顕微鏡的に測定する
- MD Anderson スコアは、CAP スコアよりも予後予測能や観察者間一致性に優れている
- 膵臓全体や周囲脂肪織、Vater 乳頭部、総胆管や十二指腸、全てを顕微鏡で評価した場合のみ、病理組織学的完全寛解と判定
- 将来的に、リンパ節転移における治療効果や、分子・免疫組織学的マーカーの開発、人工知能を用いた解析等の研究が必要である。系統的、標準化された病理組織学的評価や、正確な腫瘍径の測定、及び再現性の高い治療効果判定方法の確立が必要である。
The Pancreatobiliary Pathology Society https://pbpath.org/
Reference
Wang H, Chetty R, Hosseini M, Allende DS, Esposito I, Matsuda Y, Deshpande V, Shi J, Dhall D, Jang KT, Kim GE, Luchini C, Graham RP, Reid MD, Basturk O, Hruban RH, Krasinskas A, Klimstra DS, Adsay V. Pathologic Examination of Pancreatic Specimens Resected for Treated Pancreatic Ductal Adenocarcinoma: Recommendations From the Pancreatobiliary Pathology Society. The American journal of surgical pathology. Epub ahead of print. - 系統的、標準化された肉眼的評価と検体採取
- 繊毛病メカニズムの研究
- 一次繊毛(primary cilia; non-motile cilia)は、細胞の生体膜から突出したアンテナの様な一本の毛様体で、ほとんど全ての哺乳類細胞がもっています。

運動性繊毛(motile cilia)と違い、一次繊毛は、これまで機能を持たない単なる遺残物として見なされていましたが、近年、この一次繊毛の構造や機能異常により嚢胞性腎疾患、内臓逆位、中枢神経系や骨格形成異常、多指症、網膜萎縮、肝線維症、肥満などの繊毛病(ciliopathy)とよばれる様々な遺伝性疾患を発症することが分かってきました。

私たちは最近、Yeast Two Hybridシステムを用いた包括的なスクリーニング法により、細胞生存の要因子Aktと特異的に結合する繊毛タンパクInversinを同定し、増殖因子PDGF-AA刺激下においてAktによるInversinのリン酸化が、腎尿細管の三次元構築に必須なシグナル伝達であることを明らかにしました。
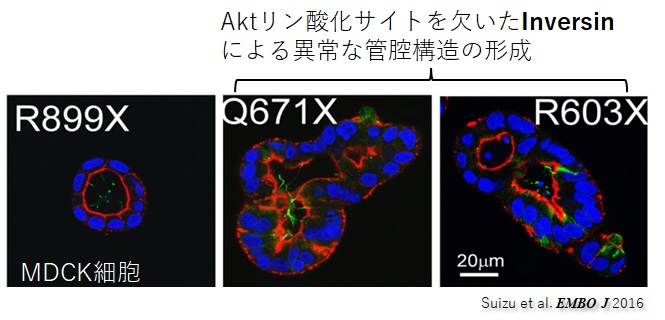
これまで、Inversin遺伝子(NPHP2)は、繊毛病である多発性嚢胞腎や内臓逆位の責任遺伝子として知られていましたが、この研究で初めて、Akt-Inversinリン酸化シグナル伝達の異常が、繊毛病発症の一因であることを証明しました。
また一次繊毛は、細胞アンテナや細胞内シグナル伝達の場として機能するだけでなく、細胞周期を静止期(G0期)で停止する機能をもちます。(Pan and Snell et al. Cell 2007; Suizu et al. Cell Commun Insights 2016)したがって、一次繊毛を消失してしまうと、シグナル伝達の撹乱と共に細胞増殖が活性化され、癌の発生や進行を促進する可能性があります。実際、膵癌、胆管癌、乳癌、前立腺癌、卵巣癌、腎癌、神経膠芽腫、メラノーマ、軟骨肉腫、髄芽腫由来の細胞では一次繊毛が消失しています。(Hassounah et al. Clin Can Res 2012)私たちは、一次繊毛制御破綻による繊毛病と癌発症メカニズム解明を目的として国内外で共同研究を進めています。 - 膵癌の術前治療効果判定のために適した病理標本作成に関する検討
- 膵癌は極めて難治性であるため、近年では術前放射線化学療法を行われる症例が多くなっている。術前治療後の手術検体の病理標本は、癌細胞のダメージや残存の程度を正確に評価できるため、病理組織学的治療効果判定は治療方針決定や予後の予測だけでなく、臨床研究の実施のために重要であると考えられている。
しかし、病理組織学的治療効果判定の方法は未だ確立されていない。今回我々は、病理組織学的治療効果判定の結果について、肉眼的腫瘍最大割面、顕微鏡的腫瘍最大割面、膵臓全体の病理標本での違いを比較検討した。その結果、顕微鏡的腫瘍最大割面での腫瘍の残存度の評価がもっとも予後と関連を示した。さらに、26%の症例では肉眼的腫瘍最大割面と顕微鏡的腫瘍最大割面の標本が異なっていたこと、3%の症例では肉眼的腫瘍最大割面に癌細胞を認めなかったことから、肉眼的に膵癌の部位を同定することは困難であることが明らかになった。その原因として、膵癌では、慢性膵炎や治療効果によって高度の線維化を伴うため、他の臓器の癌よりも肉眼的に腫瘍範囲を同定することが難しいことが考えられる。正確な治療効果判定のため、適切な病理標本の作製は極めて重要である。
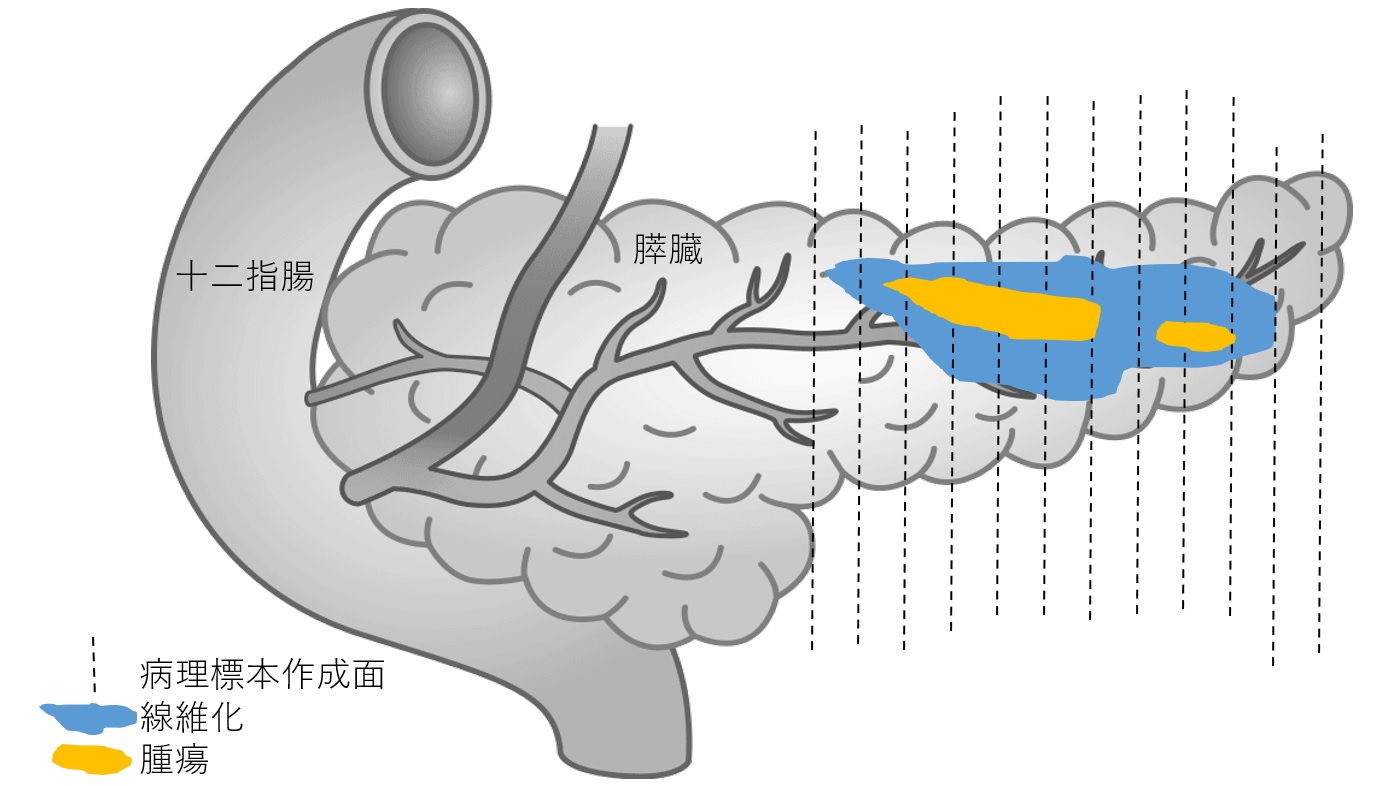
- 膵癌の新しい治療方法
術前放射線化学療法(ネオアジュバント療法) - 術前放射線化学療法(ネオアジュバント療法)
膵癌では手術の前に、抗癌剤の投与や放射線療法を行い、手術を行うというネオアジュバント療法の有用性に期待が集まっている。手術前に補助療法を行うことで、腫瘍を縮小させたり、小さな転移巣を減らしたりできる効果が期待されている。
補助療法後の膵臓の手術検体は、治療によって死滅した癌細胞の程度や、治療に抵抗して残存する癌細胞の程度を正確に評価可能な貴重な情報源である。そのため、様々な病理組織学的治療効果判定方法が提唱されているが、判定方法は未だ確立されていない。
私達は、Area of residual tumor (ART) スコアという、顕微鏡の視野数に基づいたスコアを用いて、膵癌の治療効果を評価した。その結果、ARTスコアが低い症例では、高い症例よりも、術後の予後が良好であった。また、他の判定方法よりも、ARTスコアは、評価者間の一致率が高かった。ARTスコアによる膵癌の治療効果判定方法は、簡便であり、有用な予後予測方法と考えている。
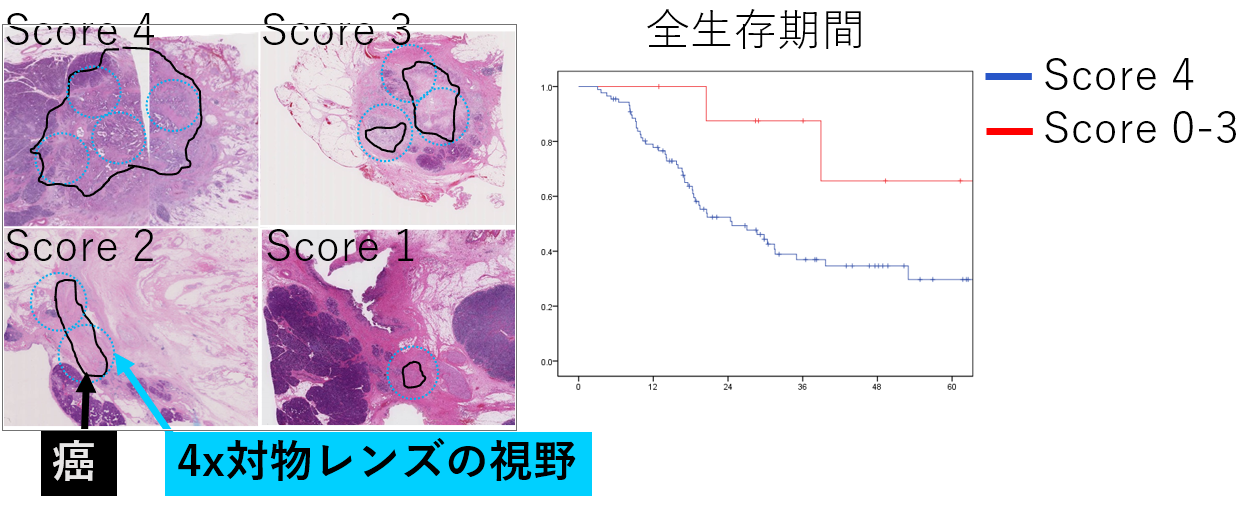
Area of residual tumor (ART) スコア Area of residual tumor (ART) スコア
参考文献
- 膵疾患の病理学的診断の現状と課題 放射線化学療法効果判定,成澤裕子,松田陽子,膵臓,2020, 35 (4); 280-292.
- Objective Assessment of Tumor Regression in Post-Neoadjuvant Therapy Resections for Pancreatic Ductal Adenocarcinoma: Comparison of Multiple Tumor Regression Grading Systems. Matsuda Y, Ohkubo S, Nakano-Narusawa Y, Fukumura Y, Hirabayashi K, Yamaguchi H, Sahara Y, Kawanishi A, Takahashi S, Arai T, Kojima M, Mino-Kenudson M. Scientific Report, 26;10(1):18278.2020.
- 膵疾患の病理学的診断の現状と課題 放射線化学療法効果判定,成澤裕子,松田陽子,膵臓,2020, 35 (4); 280-292.
- 発がん機序の解明、特に膵臓癌と加齢との関連
テロメア、テロメレースの変化 - テロメア、テロメレースの変化
発がん過程では、イニシエーターとよばれるDNA損傷作用を有する物質と、プロモーターとよばれるイニシエーターの作用を促進させる物質が作用します。それぞれ単独では、腫瘍が形成されませんが、イニシエーターの後にプロモーターが加わることで腫瘍が形成され、このことを発がんの二段階説と言われています。
これまでに我々は、イニシエーターとしてタバコ由来ニトロサミン4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK) や肉由来ニトロサミン2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline (MeIQx) をマウスに投与し形成される肺腺癌において、高脂肪食等によるプロモーターとしての作用について研究を進めてきました。また、発がんを抑制するための化学発癌物質の研究を行い、ウシ母乳由来のラクトフェリンによる腫瘍抑制効果を報告しました (Matsuda, Cancer Letters, 2006)。
ヒトでは、様々な種類の環境因子と遺伝的因子が時間的にも頻度的にも複雑に作用し、発がんに至るものと考えられます。食事や嗜好品、薬品、環境中の多数の発がん物質に常に曝されており、発がん物質の代謝・感受性に関わる遺伝子やがん遺伝子、がん抑制遺伝子の個体差ががんの発症に大きな影響を及ぼします。発がんに関連する因子の中でも、加齢が及ぼす影響は極めて重要であると考えています。その理由は、時間経過とともに遺伝子変異が蓄積すると考えられていること、癌は高齢者に多いこと、加齢性変化を我々は避けて通ることができないことが挙げられます。
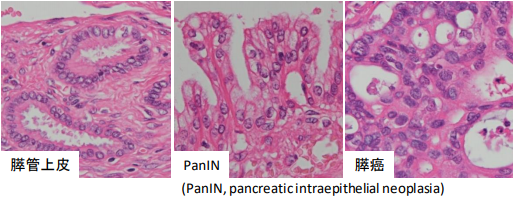
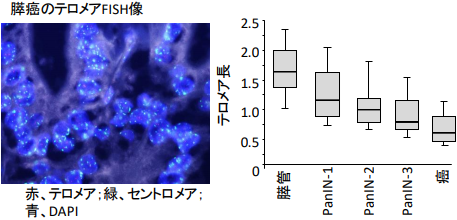
テロメアはTTAGGGの繰り返し配列から成る塩基であり、染色体末端に存在します。核分裂のたびに、テロメアの塩基配列の長さが短くなり、テロメア長が短縮すると染色体末端同士の癒合が惹起され、それにより染色体の異常が引き起こされるため、テロメアは命の回数券ともよばれています。Fluorescent in situ hybridization (FISH) 法を行い、膵臓の発癌過程 (膵管上皮⇒pancreatic intraepithelial neoplasia, PanIN⇒癌, 図1) におけるテロメア長を定量解析したところ (図2)、テロメア長の短縮は病理組織学的異常が生じる前から始まっていること、テロメア長の短縮の最も大きな原因は加齢であることが明らかになりました (Matsuda, PLoS ONE, 2015)。膵臓の悪性腫瘍の90%を占める浸潤性膵管癌の発癌過程では、このようなテロメア長の短縮による染色体不安定性がほとんど全ての症例に認められました。さらに、FISH解析によるテロメア長の異常は細胞診検体の診断にも応用できることを報告しました (Matsuda, Cytopathology, 2018)。
膵臓の発癌では、遺伝的要因や環境要因だけでなく、加齢に伴うテロメア長短縮によるイニシエーションが中心的役割を担っていると考えています。また、加齢はイニシエーターであるだけでなく、糖尿病や膵炎等の様々な疾患発症に関与し、プロモーターとして作用します。プロモーターの段階で、膵管上皮細胞が染色体不安定性をきたして異常に増殖し、PanINが形成されると考えています。PanINにおいて、テロメア異常による染色体不安定性が進行し、一部の細胞が不死化を獲得し癌化に至るのではないかと考えています。このような加齢による膵発癌の分子病理学的機序の解明により、高齢化社会でますます問題となる癌の予防、診断、治療に結び付く成果の獲得を目指しています。 - 新規分子標的治療薬開発を目指したトランスレーショナルリサーチ
癌幹細胞関連分子、免疫チェックポイント関連分子 - 癌細胞は不均一な細胞の集団であり、がん幹細胞といわれる自己複製能、多分化能を有する一部の特殊な細胞の存在が近年提唱されました。
癌幹細胞は、治療抵抗性や遠隔転移で中心的役割を担うため、重要であり、実験的には様々な癌幹細胞マーカーを発現していることが報告されています。膵臓の発癌過程における癌幹細胞について解析したところ、CD24, CD44, ESA, CXCR4, Nestinといった癌幹細胞マーカー陽性細胞の割合は、正常膵管⇒PanIN-1,2,3⇒膵癌に至る発がん過程の進行とともに増加しました (Kure, Matsuda, Int J Oncol, 2012)。
Nestinは、細胞骨格タンパク質の一つである中間径フィラメントであり、膵癌の細胞質内にクモの巣のような線維網を形成しています (図3)。
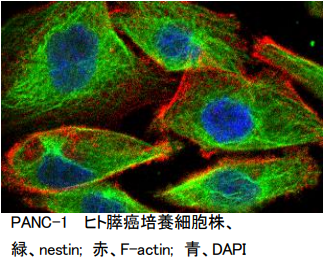
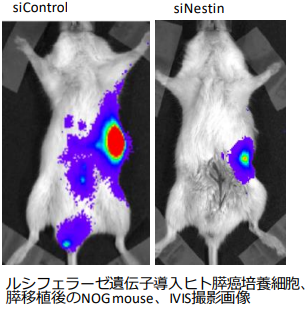
Nestinは、神経幹細胞マーカーとして報告され、膵臓の外分泌前駆細胞や活性化した間質細胞に高発現しています。また、癌組織中の新生血管にnestinタンパク質の過剰発現を認めます (Yamahatsu, Matsuda, Int J Oncol, 2012)。short hairpin RNA (shRNA) を用いヒト膵癌細胞のNestinを抑制すると、癌細胞の遊走・浸潤の抑制、細胞間接着の亢進、F-actin線維の発現変化、細胞形態変化、及びマウス肝転移が抑制されました (Matsuda, Cancer Biol Ther, 2011)。またNestinを抑制すると幹細胞性の指標であるスフェア形成能やside population細胞が抑制されたことから、Nestinが幹細胞性の制御を介して転移を制御することが明らかになりました (Matsuda, Am J Pathol, 2014)。マウスにヒト膵癌細胞を移植し、ヒトNestin small interfering RNA (siRNA) を尾静脈投与したところ、controlのsiRNAと比べ、膵腫瘍増大の抑制と転移巣形成の抑制を認め (図4, Matsuda, Pancreas, 2016)、マウスにヒト膵癌細胞を移植し、マウスNestin siRNAを腫瘍内投与したところ、controlのsiRNAと比べ、膵腫瘍増大の抑制、及び新生血管の形成が抑制されました (Yamahatsu, Matsuda, Int J Oncol, 2012)。
shRNAやsiRNAといったRNA干渉だけでなく、Nestinを抑制する方法としてリン酸化を阻害することを考えました。NestinにはCDK5, cdc2 kinaseリン酸化部位が2カ所報告されており、それぞれを変異させリン酸化を阻害しました。その結果、Nestinのリン酸化部位を2カ所とも変異させると細胞浸潤能の抑制とマウス肝転移抑制を認めました (Matsuda, Cancer Science, 2017)。Nestinのリン酸化阻害剤の網羅的探索によって、CDK、AKT、Aurora阻害剤によるNestinを標的とした治療が有用である可能性が示されました。
Nestinは膵癌細胞の遊走・浸潤・転移・幹細胞性、及び血管新生を制御しており、分子標的治療薬として非常に有望であると考えています。我々は、癌幹細胞関連分子以外にも、免疫チェックポイント、増殖因子受容体、MAPキナーゼ、細胞外基質に関連する分子と癌との関連を研究しています。以上のような研究によって、難治性癌の新しい治療法の開発につながることを目指しています。 - 癌の形態的変化の解析による外科病理学研究
ネオアジュバント療法後の癌細胞の変化 - 膵癌は日本の部位別がん死亡率において、男性で5位、女性で3位と上位にあり、男女ともに罹患率と死亡率が増え続けています。膵癌の5年生存率は約6%ときわめて予後不良のままです。
その理由として、診断時に既に局所進行切除不能癌や遠隔転移を有する切除不能膵癌の症例が約70%を占めること、切除不能膵癌に対する有効な治療法がないことが挙げられます。そのため、切除不能膵癌に対する新規治療法の確立が待ち望まれています。
切除不能膵癌に対しては様々な化学療法、放射線療法が試みられており、「科学的根拠に基づく膵癌診療ガイドライン2013年版」では局所進行膵癌に対してゲムシタビン、TS-1、エルロチニブ、遠隔転移を有する膵癌に対してFOLFIRINOX療法 (オキサリプラチン、イリノテカン塩酸塩水和物、フルオロウラシル、レボホリナートカルシウム)、ゲムシタビン、ナブパクリタキセルが推奨されています。また、近年では術前に化学放射線療法を行うネオアジュバント療法が膵癌に対して行われるようになり、原発巣縮小による切除率の向上や遠隔転移巣の抑制が期待されています。そのため、ネオアジュバント療法後の膵切除検体を用い、病理組織学的治療効果を判定する機会が日常の病理診断で多くなってきました(松田,膵癌治療up-to-date 2015)。
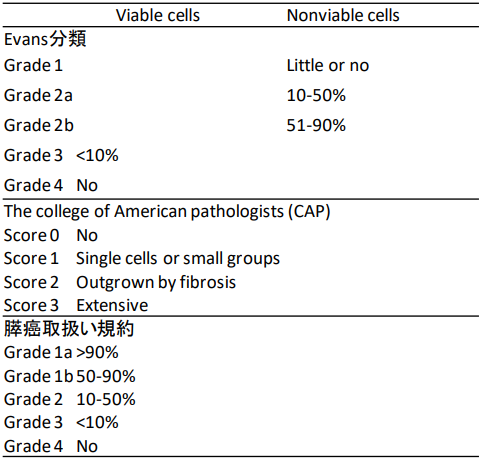
膵癌に対する病理組織学的治療効果判定には、日本で従来より用いられているEvans分類、アメリカで用いられているThe college of American pathologists (CAP) の評価方法、膵癌取り扱い規約第7版 (2016年) の評価方法など様々な方法があり (表1)、統一された国際基準がありません。また、いずれの評価方法も再現性、客観性や、判定の臨床的意義について、多くの課題が残されています。例えば、現在の判定方法では、癌細胞がnonviableであるかviableであるのかを病理標本で判定する際に変性した癌細胞をどちらにするのか、また残存した癌細胞の割合をどのように評価するのか、病理医同士での捉え方を一致させることが困難です。さらに、日本と欧米では、膵癌に対する放射線化学療法のレジメが異なるため、日本での膵癌ネオアジュバント療法後の病理組織学的治療効果判定方法の確立は重要であると考えられます。そのため、膵癌の治療後の病理組織学的な変化について、国内外の多施設と共同研究を行っています。