|
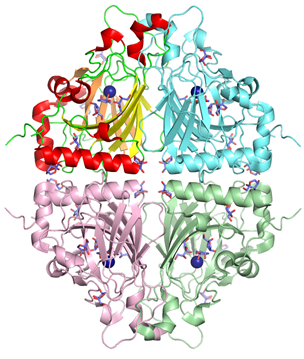
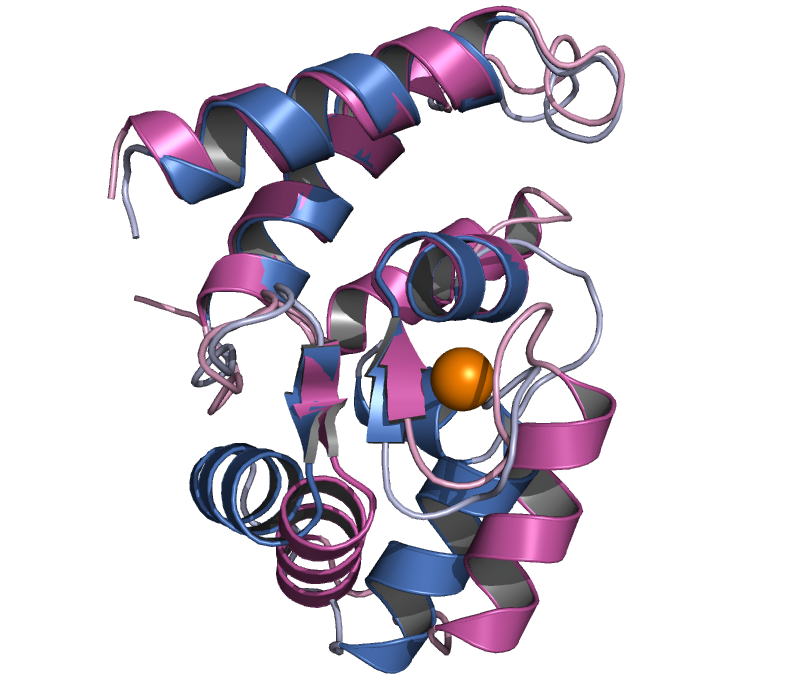
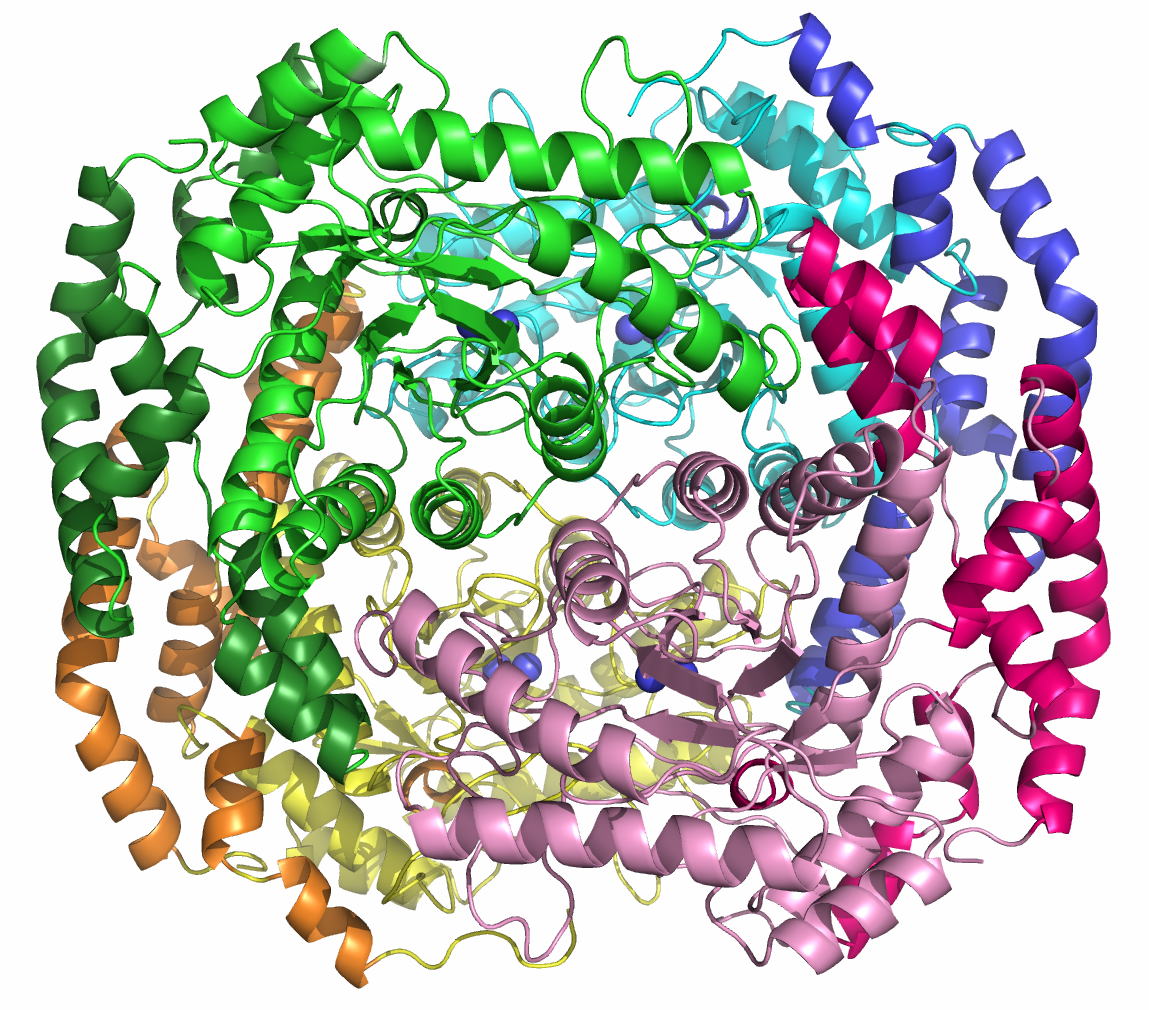
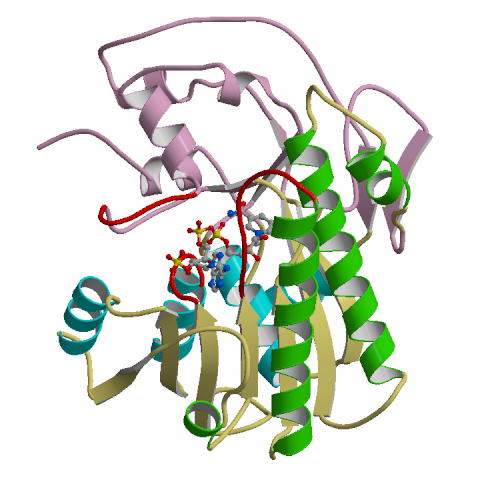
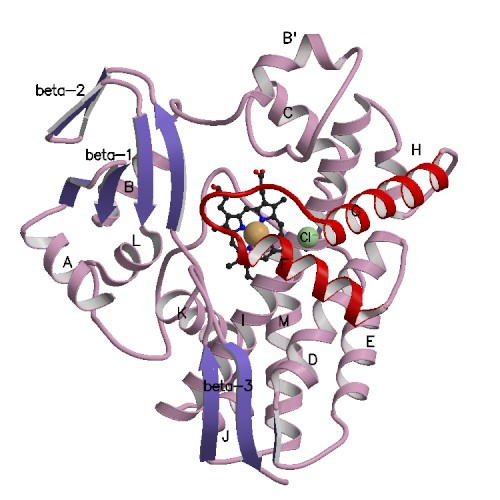
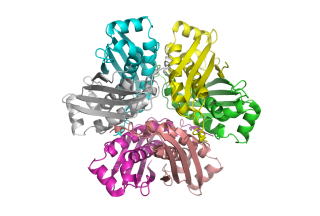
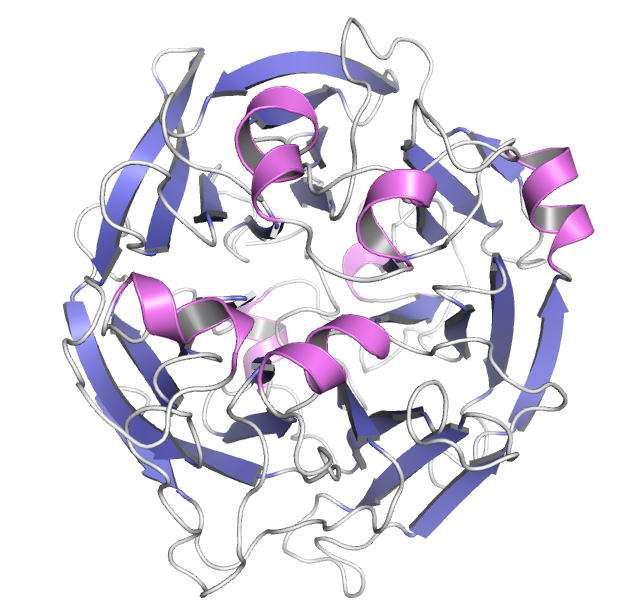
Acinetobacter sp. DL-28 L-ribose isomerase (4Q0P) L-Ribose, a pentose, is not known to exist
in nature. Although organisms typically do not have a metabolic pathway that
uses L-ribose as a carbon source, prokaryotes use various sugars as carbon
sources for survival. Acinetobacter sp. DL-28 has been shown to
express the novel enzyme, L-ribose isomerase (AcL-RbI), which catalyzes
reversible isomerization between L-ribose and L-ribulose. AcL-RbI showed the
highest activity to L-ribose, followed by D-lyxose with 47 % activity, and
had no significant amino acid sequence similarity to structure-known
proteins, except for weak homology with the D-lyxose isomerases from Escherichia
coli O157:H7 (18 %) and Bacillus subtilis strain (19 %). Thus,
AcL-RbI is expected to have the unique three-dimensional structure to
recognize L-ribose as its ideal substrate. The X-ray structures of AcL-RbI in
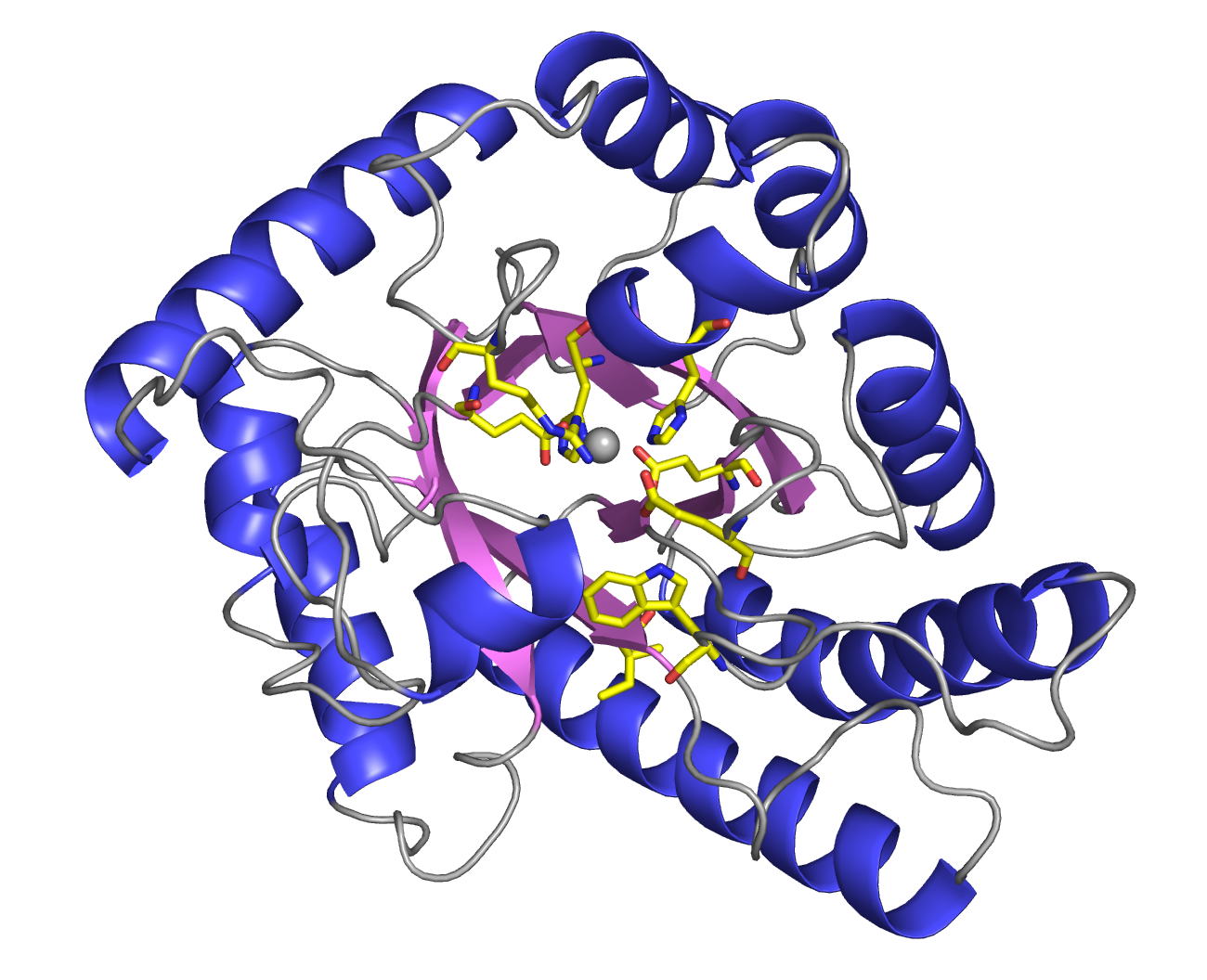
complexes with substrates were determined. AcL-RbI had a cupin-type beta-barrel structure, and the catalytic
site was found between two large beta-sheets with a bound metal ion. The
catalytic site structures clearly showed that AcL-RbI adopted a cis-enediol intermediate mechanism for the
isomerization reaction using two glutamate residues (Glu113 and
Glu204) as acid/base catalysts.
In its crystal form, AcL-RbI formed a unique homo-tetramer with many substrate
sub-binding sites, which likely facilitated capture of the substrate. FEBS J. (2014) 281, 3150-3164. |
|
|
Aspergillus oryzae Aspartic proteinase (1IAD, 1IZE) 黄麹菌Aspergillus oryzaeアスパラギン酸プロテアーゼおよびその阻害剤(ペプスタチンA)複合体の1.9Å分解能X線結晶解析を行い,疎水性アミノ酸に加えて正電荷をもつアミノ酸(アルギニン・リシン)のC末端側でも加水分解するという黄麹菌酵素特有の基質特異性について新たな知見を得た。
|
|
|
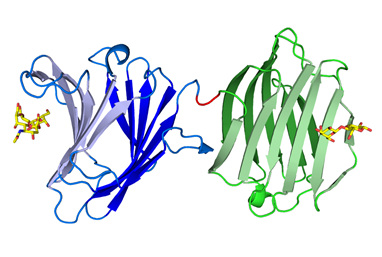
Clostridium
botulinum hemagglutinin (HA)
subcomponent in ) in complexes with sialylated
oligosaccharides (4EN6, 4EN8) ボツリヌス菌が産生する神経毒素は,非毒素成分および3つのヘマグルチニン成分(HA33,HA17,HA70)とともにプロジェニター毒素複合体を形成している。ヘマグルチニン成分は,上皮細胞上の糖鎖に結合することにより毒素の侵入を助けている。ヘマグリチニン成分の1つであるHA70の糖鎖認識機構について新たな知見を得るために,タイプC毒素のHA70(HA70/C)とシアル化糖鎖との複合体のX線結晶解析および糖鎖マイクロアレイによる結合アッセイを行った。その結果,HA70/Cは,α2-3-,α2-6-シアル化糖鎖の両方を認識し結合することができるが,その親和性は,α2-3-シアル化糖鎖の方が,α2-6-シアル化糖鎖よりも高いことがわかった。 FEBS Lett. (2012) 586,
2404-2410. |
|
|
Endolysin
(Psm) encoded by episomal
phage phiSM101 of enterotoxigenic Clostridium perfringens
(4KRT) グラム陽性菌は,およそ250Åの厚さの細胞壁を持ち,細胞の形態を保っている。細胞壁は,N-アセチルグルコサミンとN-アセチルムラミン酸が交互にb(1→4)結合したグリカン鎖を8〜12アミノ酸のペプチド鎖が架橋した網目構造のペプチドグリカンからなる。エンドライシンは,細菌に感染したファージ由来の遺伝子にコードされており,細胞壁ペプチドグリカンを加水分解し,溶菌化を導く酵素群である。エンドライシンは,細菌の外側からも作用し,特異的に宿主細菌を死滅させることから,新たな抗生物質として注目されている。本研究では,ガス壊疽や食中毒の原因となるウェルシュ菌(Clostridium
perfringens, C. perfringens)ファージ由来のエンドライシン(Psm)について,全長タンパク質(Psm)および触媒ドメイン(Psmcat)のX線結晶解析を行った。Psmは,N末側にGH25ファミリー(リゾチーム)に属する触媒ドメインと,C末側に細胞壁結合ドメイン(cell
wall binding domain, CBD)を持つ。CBDは,2つの細菌性SH3(SH3_3,pfam08239)ドメインが近似的2回対称に配置された新奇な構造をとっていた。通常,SH3ドメインはペプチドを認識する。このことから,PsmのCBDは,ペプチドグリカン中のペプチド鎖を特異的に認識して,触媒ドメインがグリカン鎖を加水分解するのを助けているという機構が考えられる。 Molecular
Microbiology (2014) 92, 326–337. |
|
|
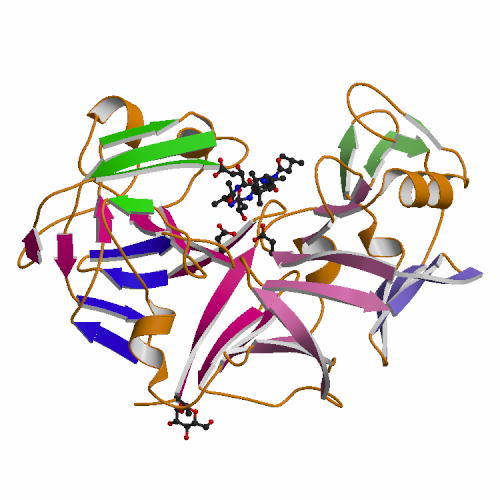
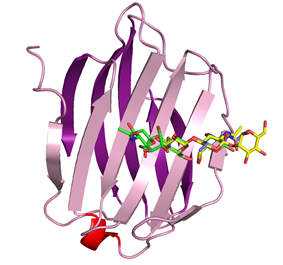
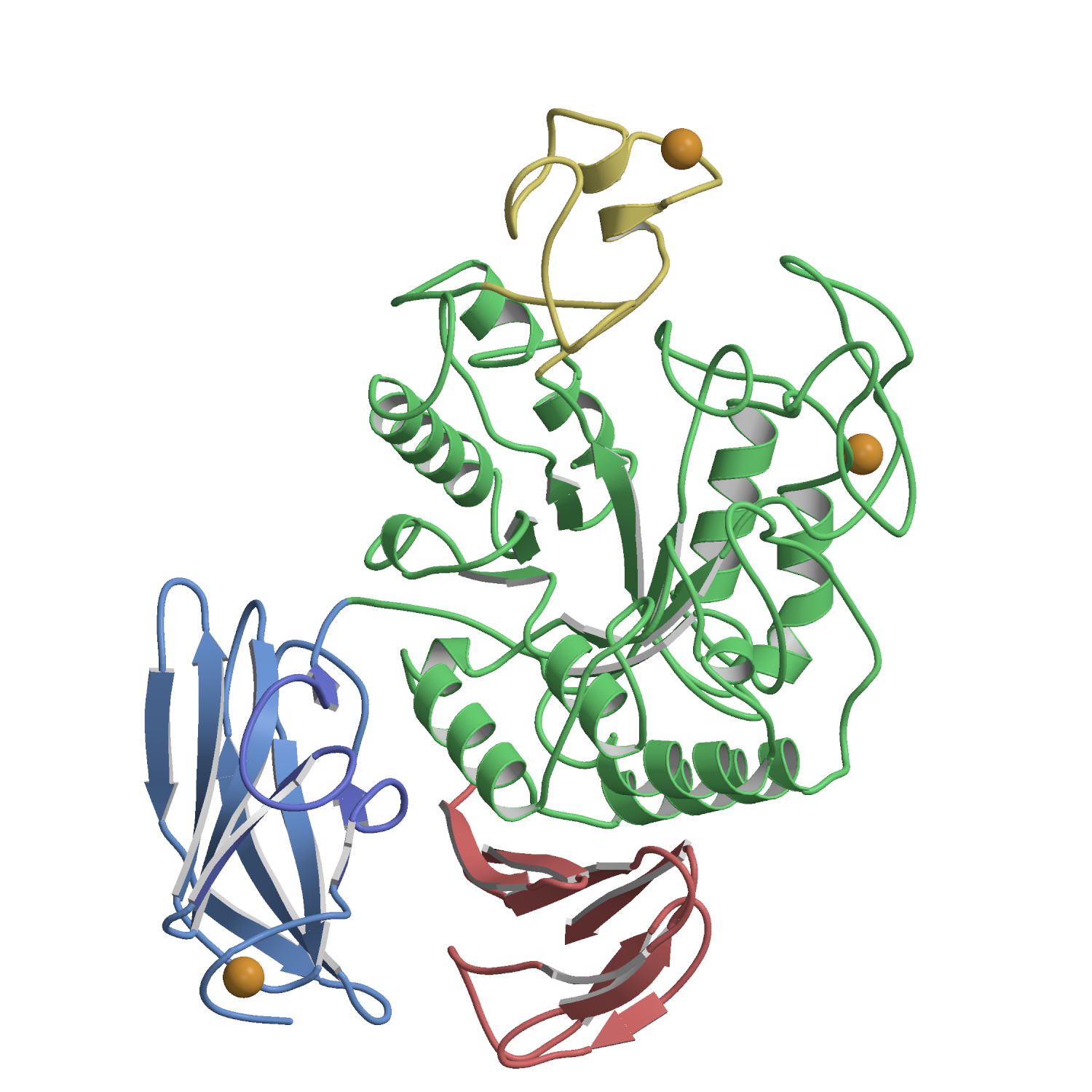
Human
galectin-8 in a protease-resistant mutant form (3VKM) ガレクチン8は,2つの異なる糖鎖認識ドメインをN末側(N-CRD),C末側(C-CRD)に持つタンデムリピートタイプのガレクチンで,細胞−マトリックス相互作用や細胞接着に関与している。N-CRDはa2-3シアル化糖鎖に強い親和性を持ち,C-CRDはN-CRDより糖鎖親和性が低い。これまでに多くのガレクチンのX線結晶解析が報告されているが,それらはすべて1つのCRDを対象としたもので,2つのCRDを含むX線構造はまだない。これは2つのCRDをつなぐリンカー部分のプロテアーゼ感受性が高いためである。今回,2つのCRDを持つプロテアーゼ耐性変異型ガレクチン8(G8Null)と糖鎖との複合体のX線解析に成功した。また,疑似2量体を形成したガレクチン8のN-CRD(G8N)についてもX線結晶解析を行った。これらの結果より,2つのCRDの糖鎖認識の違いを明らかにし,さらにガレクチン8のCRDおよび分子の集合状態についての新たな知見を得た。 FEBS J. (2012) 279, 3937-3951. |
|
|
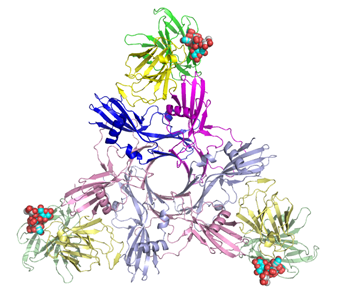
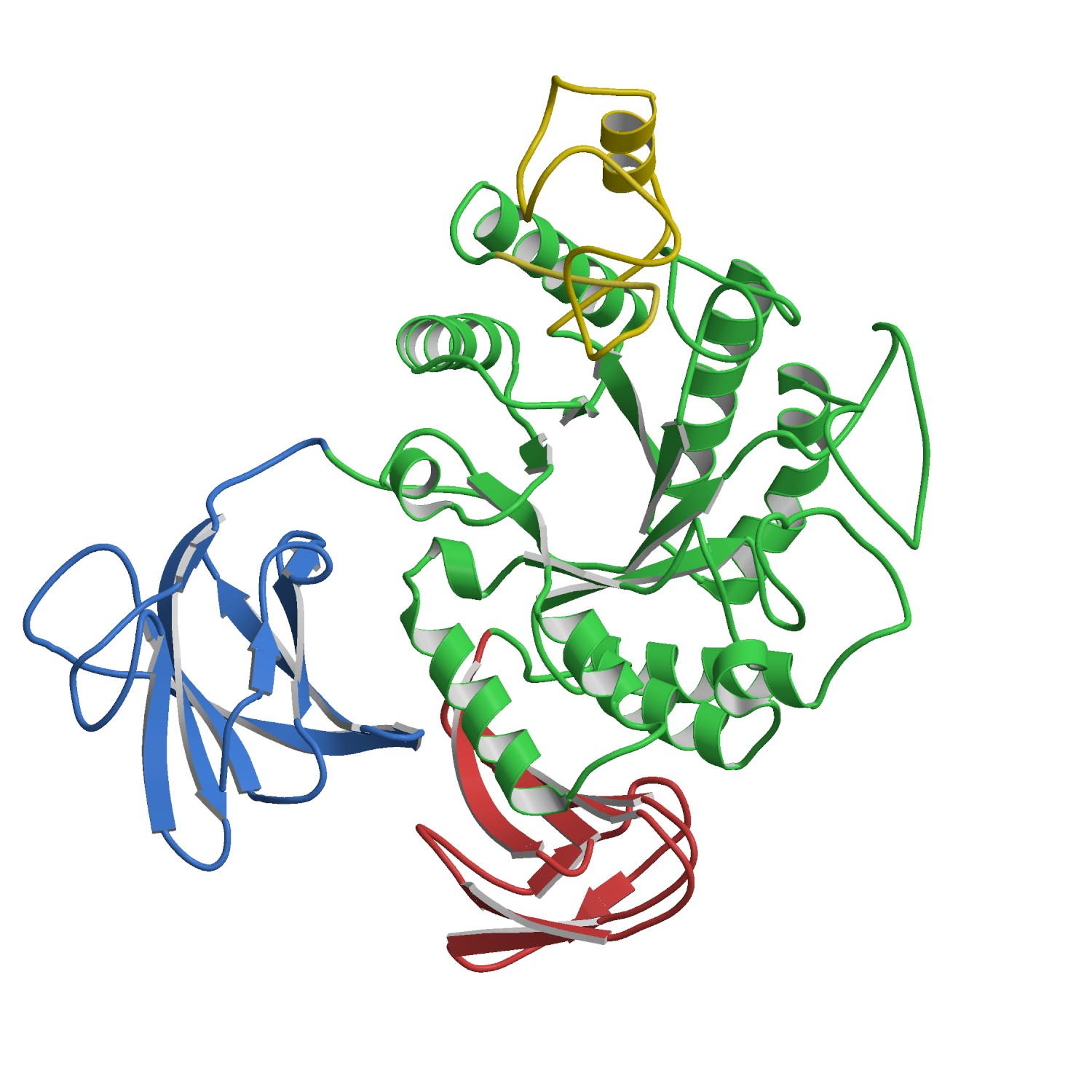
Human
galectin-9 C-terminal domain (3NV3) ガレクチンとは,細胞表面上の糖鎖を認識し結合する動物レクチンタンパク質で,近年,生体内で様々な興味深い機能を持つことが明らかとなり,注目されている。これまでにヒトガレクチンは14種類発見されており,その構造からプロトタイプ,キメラタイプ,タンデムリピートタイプに分けられる。ガレクチン9は,タンデムリピートタイプに属し,免疫応答において,好酸球遊走因子や活性化T細胞のアポトーシスを誘導因子等として働いていることが報告されている。ガレクチン9は,枝分かれ糖鎖(分枝糖鎖)およびシアル化糖鎖に対して親和性が高い。ガレクチン9の糖鎖認識機構と,それが持つ機能との関係について新たな知見を得るため,ガレクチン9・糖鎖複合体の立体構造をX線結晶解析により決定した。 J.
Biol. Chem.
(2010) 285, 36969-36976. |
|
|
Human and mouse Iba1 (2D58, 1WY9) 哺乳類の中枢神経系は主に神経細胞と3種類のグリア細胞(アストロサイト,オリゴデンドロサイト,ミクログリア)から構成されている。ミクログリアは,神経変性疾患・神経損傷時等に活性化され,神経の機能維持・生存・損傷修復に働く。ミクログリア特異的カルシウム結合タンパク質Iba1(Ionized calcium binding adaptor
molecule 1)は活性化ミクログリアで発現上昇する新規タンパク質で,Iba1がPLCγを介してRacシグナル伝達系で機能することが現在までに明らかになっている。また同時にIba1・F-アクチンが集積することが観察され,Iba1のF-アクチンに対する結合能・架橋能が示され細胞骨格再構成にIba1が関与している可能性が示された。本研究ではIba1の有するF-アクチン結合能・架橋能をはじめ,ミクログリア活性化における機能の理解を得るため,ヒトおよびマウス由来のIba1(H-Iba1およびM-Iba1)のX線結晶構造解析を行った。
|
|
|
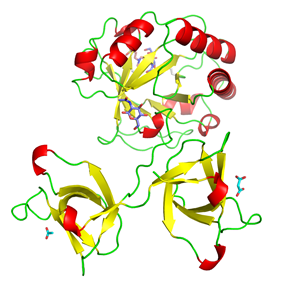
Pseudomonas
cichorii Tagatose epimerase (2OU4)
J. Mol. Biol. (2007) 374, 443-453. |
|
|
Pseudomonas stutzeri Rhamnose Isomerase (2HCV,
2I56, 2I57)
|
|
|
Sporobolomyces salmonicolor Aldehyde reductase 2 (1ZZE, 1Y1P)
|
|
|
Sulfolobus tokodaii Cytochrome P450 (1UEB)
|
|
|
Sulfolobus tokodaii Molybdenum cofactor biosynthesis protein C, ST0472
(2OHD)
Acta Crystallogr. Sect F. (2008) 64, 589-592. |
|
|
Sulfolobus tokodaii Selenium-binding protein, ST0059 (2ECE)
|
|
|
Thermoactinomyces vulgaris R-47 alpha-Amylase 1 (1JT1 etc.)
J. Mol. Biol. (2004) 335, 811-822. |
|
|
Thermoactinomyces
vulgaris
R-47 alpha-Amylase 2 (1JT2 etc.)
|
|